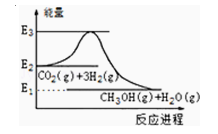
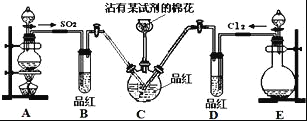
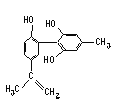
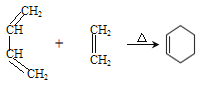��Ŀ����
����Ŀ������������ⶪ�����������ˮ������Ⱦ������к��е��ؽ������Ӷ�ֲ�������ж������ã��������廹���˺��˵���ϸ�������Ρ����������ȵȡ�ijͬѧ����һЩ�����ﳣ���µ��ܶȻ��������±���
���� | FeS | CuS(��ɫ) | MnS(��ɫ) | PbS | HgS | ZnS |
Ksp |
|
|
|
|
|
|
���� | Fe(OH)3 | Al(OH)3 | Mn(OH)2 | Pb(OH)2 | Zn(OH)2 | |
Ksp |
|
|
|
|
|
(1)��ͬѧ�ں�����ͬŨ��Mn2+��Cu2+����Һ�еμ�Na2S��ϡ��Һ���۲쵽�ȳ��ֵij�����ɫ��______����ʵ��˵������ͬ������KspԽС�����ʵ��ܽ��____(����Խ��������ԽС��)��
(2)��֪�����������ӿ�ʼ������pHΪ1.0�������Һ�� Fe3+�����ʵ���Ũ��Ϊ______������Һ�к�����Fe3+��Ũ�ȵ� Al3+������ pH ʹ Fe3+������ȫʱ������_____Al(OH)3����(����������������������)��
(3)ij��ҵ��ˮ�к���Cu2+��Pb2+��Hg2+���ʣ����ó���ת��ԭ�������˼��������__________(�����)��д��������Լ���ȥPb2+ʱ���������ӷ�Ӧ����ʽ_______��
A.FeS B.Fe2O3 C.Na2S D.ZnO
(4)�� FeCl3��6H2O����õ�������ˮFeCl3����Ҫ���еIJ�����_________��
���𰸡���ɫ ԽС 2.6 mol/L ���� C Pb2++S2-=PbS�� ��HCl�����м���
��������
��1��ͬ���ͳ�����KspԽС���ܽ��ԽС��Խ����������
��2������Fe��OH��3���ܶȻ���������c��Fe3+��������Al��OH��3��Ksp���������ж��Ƿ���Al��OH��3������
��3�������Լ�Ӧ������Ϊ������������µ����ʣ���ü��������Ե����ʺ�ת��Ϊ�����ܵ����ʣ�
��4���Ȼ�����������ˮ�����������������ò����������Ȼ�����Ӧ���Ȼ��������м���ʧȥ�ᾧˮ��
��1������ͬ������KspԽС�����ʵ��ܽ��ԽС������ں�����ͬŨ��Mn2+��Cu2+����Һ�еμ�Na2S��ϡ��Һ���۲쵽�ȳ��ֵij����Ǻ�ɫ��CuS��
��2����ʼ����ʱ����Һ��Qc=Ksp�������ӿ�ʼ������pHΪ1.0��
���ʱ��Һ��![]() ��
��
�����Һ�� Fe3+�����ʵ���Ũ��Ϊ![]() ��
��
Fe3+������ȫʱ����Һ�����������ӵ�Ũ��Ϊ![]() ��
��
����Һ��pHԼΪ3��
�����ӿ�ʼ����ʱ��Һ�����������ӵ�Ũ��Ϊ![]() ��
��
��Һ��pHԼΪ3��
���Fe3+������ȫ�������ӿ�ʼ����ʱpH������ͬ��ʹ Fe3+������ȫʱ�����к���Al(OH)3������
��3��ij��ҵ��ˮ�к���Cu2+��Pb2+��Hg2+���ʣ����ó���ת��ԭ�������˼��������Na2S����ȥPb2+ʱ���������ӷ�Ӧ����ʽΪPb2++S2-=PbS����
��4���� FeCl3��6H2O����õ�������ˮFeCl3��Ҫ����FeCl3��ˮ�⣬���Ҫ���еIJ���Ϊ��HCl�����м��ȡ�

 ϰ�⾫ѡϵ�д�
ϰ�⾫ѡϵ�д�