题目内容
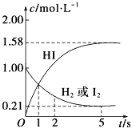
【题目】698K时,向VL的密闭容器中充入2molH2(g)和2molI2(g),发生反应:H2(g)+I2(g)![]() 2HI(g) ΔH=-26.5kJ·mol-1,测得各物质的物质的量浓度与时间变化的关系如图所示。
2HI(g) ΔH=-26.5kJ·mol-1,测得各物质的物质的量浓度与时间变化的关系如图所示。
请回答下列问题:
(1)V=______。
(2)该反应达到最大限度的时间是_______,该时间内平均反应速率v(HI)=________。
(3)下列说法中可以说明反应2HI(g)![]() H2(g)+I2(g)已达到平衡状态的是_____。
H2(g)+I2(g)已达到平衡状态的是_____。
A.单位时间内生成nmolH2的同时生成2nmolHI
B.温度和体积一定时,容器内压强不再变化
C.条件一定,混合气体的平均相对分子质量不再变化
D.温度和压强一定时,混合气体的密度不再变化
(4)该反应达到平衡状态时,__________(填“吸收”或“放出”)的热量为______。
【答案】 2 5s 0.316mol·L-1·s-1 A 放出 41.87 kJ
【解析】
(1)根据图象知,氢气和碘初始物质的量浓度为1mol/L,所以容器的体积为2mol÷1mol/L=2L;
(2)当反应达到平衡状态时,各物质的浓度不变,根据图象知,当反应物和生成物浓度不变时,时间为5s;该时间内HI浓度增加了1.58mol/L,则平均反应速率v(HI)=△c÷△t=1.58mol/L÷5s=0.316mol·L-1·s-1;
(3)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。则
A.单位时间内生成nmolH2的同时生成2nmolHI说明正逆反应速率相等,达到平衡状态,A正确;
B.反应前后体积不变,温度和体积一定时,容器内压强始终不变,不能说明反应达到平衡状态,B错误;
C.反应前后气体质量和气体物质的量均不变,混合气体的平均分子量始终不发生变化,不能说明反应达到平衡状态,C错误;
D.密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,温度和压强一定时,混合气体的密度不再变化不能说明反应达到平衡状态,D错误。
答案选A。
(4)该反应的正反应是放热反应,所以当反应达到平衡状态时会放出热量,根据碘化氢和反应热之间的关系式可知放出的热量为1.58mol/L×2L×26.5kJ/mol/2=41.87 kJ。

 阅读快车系列答案
阅读快车系列答案