题目内容
【题目】X、Y、Z、M、W是原子序数由小到大排列的五种短周期主族元素,其中X、Z、M、W四种元素的原子序数之和为32,在元素周期表中X是原子半径最小的元素,Y原子的最外层电子数是其电子层数的2倍,Z、M左右相邻,M、W位于同主族。回答下列问题:
(1)Y在周期表中的位置是________, W的阴离子符号是_____。
(2)Z的单质的结构式为________。标准状况下,试管中收集满Z的简单氢化物后倒立于水中(假设溶质不向试管外扩散),一段时间后,试管内溶液中溶质的物质的量浓度为_______。
(3)由X、Z、M三种元素组成的化合物是酸、碱、盐的化学式分别为_________、______________、_____________ (各举一例)。
(4)写出加热时Y的单质与W的最高价氧化物的水化物的浓溶液发生反应的化学方程式:____________。
【答案】第二周期IVA族 S2- N≡N 0.045mol/L(或1/22.4mol/L) HNO3(或HNO2) NH3·H2O NH4NO3(或NH4NO2) C+2H2SO4(浓) ![]() CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
【解析】
试题X、Y、Z、M、W是原子序数由小到大排列的五种短周期主族元素,其中X、Z、M、W四种元素的原子序数之和为32,在元素周期表中X是原子半径最小的元素,则X是H元素;Y原子的最外层电子数是其电子层数的2倍,则Y是C元素;Z、M左右相邻,M、W位于同主族,则Z、M、W分别为N、O、S元素。
(1)Y在周期表中的位置是第二周期IVA族, W的阴离子符号是S2-。
(2)Z的单质是氮气,其结构式为N≡N。标准状况下,试管中收集满Z的简单氢化物(即氨气),后倒立于水中(假设溶质不向试管外扩散),一段时间后,试管内充满溶液。假设试管的容积为22.4L,则氨气的物质的量为1mol,溶解后得到氨水的体积也是22.4L,所以溶液中溶质的物质的量浓度为0.045mol/L(或1/22.4mol/L)。
(3)由H、N、O三种元素组成的化合物是酸、碱、盐的化学式分别为HNO3(或HNO2)、NH3·H2O、NH4NO3(或NH4NO2)。
(4)碳与浓硝酸在加热时发生反应的化学方程式为C+2H2SO4(浓) ![]() CO2↑+2SO2↑+2H2O。
CO2↑+2SO2↑+2H2O。

 名校课堂系列答案
名校课堂系列答案【题目】H2O2是实验室常见的强氧化剂,在医疗上可用作消毒剂等。
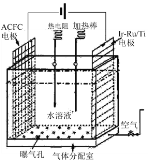
(1)一种正在开发的利用O2和H2O作原料通过化合制取H2O2的方法,其原理如图所示。该方法制取H2O2的总化学反应方程式为____。
(2)为探究外界条件对H2O2分解化学反应速率的影响,相关实验设计如下表所示:
试管 编号 | 实验目的 | H2O2溶液 | 温度 | 水的 体积/mL | FeCl3溶液体积/mL | |
质量 分数 | 体积/mL | |||||
Ⅰ | 为编号Ⅱ实验参照 | 12% | 5.0 | 常温 | 0 | 0 |
Ⅱ | 温度对反应速率的影响 | ( ) | 5.0 | 60℃ | 0 | 0 |
Ⅲ | 为编号Ⅳ实验参照 | 4.0% | 5.0 | 常温 | ( ) | 0 |
Ⅳ | ( ) | 4.0% | 5.0 | 常温 | 0 | 1.0 |
填写表中缺少的内容:Ⅱ_______;Ⅲ__________;Ⅳ_________。
(3)由铂(Pt位于左边)和金(Au位于右边)组成的纳米棒放入H2O2溶液中(如图),纳米棒将发生定向移动。
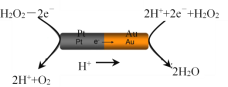
则:Au一侧为电池的____极(选填:“正”或“负”);纳米棒向____(选填:“左”或“右”)移动。