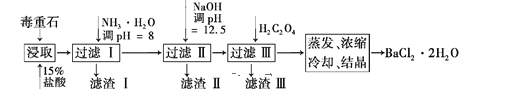
题目内容
【题目】某种 “全氢电池”的工作原理如图所示。下列说法错误的是( )

A.右边吸附层中发生了氧化反应
B.负极的电极反应是H2-2e-+2OH-===2H2O
C.该电池总反应是H++OH-===H2O
D.电解质溶液中Na+向右移动、ClO4-向左移动
【答案】A
【解析】
A. 由电子流向可知,右边吸附层为正极,发生了还原反应,故A错误;
B. 由电子流向可知,左边吸附层为负极,发生了氧化反应,电极反应是H2-2e-+2OH-=2H2O,故B正确;
C. 负极电极反应是H22e+2OH═2H2O,正极电极反应是2e+2H+═H2,电池的总反应为H++OH-=H2O,故C正确;
D. 原电池中阳离子移向正极,阴离子移向负极,所以电解质溶液中Na+向右正极移动,ClO4向左负极移动,故D正确。
故选A。

练习册系列答案
相关题目
【题目】短周期元素A、B、C、D在元素周期表中的位置如图所示,其中A所处的周期序数与主族序数相等。
B | D | |
A | C |
请回答下列问题:
(1)A在周期表中的位置是_____;D单质的电子式为_____。
(2)C、D的最简单氢化物中,稳定性较强的是_____(填化学式);C的最高价含氧酸是____(填“离子”或“共价”)化合物。
(3)A、D的简单离子的半径大小关系为:_____(用化学式填空);用一个反应可证明元素B、D的非金属性强弱关系,该反应的化学反应方程式为______。