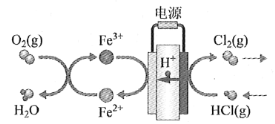
题目内容
【题目】下列关于晶体的说法中,不正确的是( )
①晶体中原子呈周期性有序排列,有自范性;而非晶体中原子排列相对无序,无自范性
②含有金属阳离子的晶体一定是离子晶体
③共价键可决定分子晶体的熔、沸点
④![]() 的晶格能远比NaCl大,这是因为前者离子所带的电荷数多,离子半径小
的晶格能远比NaCl大,这是因为前者离子所带的电荷数多,离子半径小
⑤晶胞是晶体结构的基本单元,晶体内部的微粒按一定规律作周期性重复排列
⑥晶体根据结构和性质只可分为分子晶体、原子晶体、离子晶体和金属晶体四大类
⑦干冰晶体中,一个![]() 分子周围有12个
分子周围有12个![]() 分子紧邻;CsCl和NaCl晶体中阴、阳离子的配位数都为6。
分子紧邻;CsCl和NaCl晶体中阴、阳离子的配位数都为6。
A.①②③⑥B.②③④C.④⑤⑥D.②③⑥⑦
【答案】D
【解析】
①晶体中粒子在三维空间里呈周期性有序排列,有自范性;而非晶体中原子排列相对无序,无自范性,故①正确;
②含有金属阳离子的晶体是离子晶体或金属晶体,金属晶体是金属阳离子和自由电子构成的,故②错误;
③分子晶体的熔、沸点由分子间作用力决定,与分子中的共价键无关,故③错误;
④离子晶体中离子半径越小,离子所带电荷越多,晶格能越大,MgO和NaCl两种晶体中,半径:Mg2+<Na+,且镁离子带电荷多,则MgO的晶格能较大,所以其熔点比较高,故④正确;
⑤晶胞是描述晶体结构的基本单元,晶体内部的微粒按一定规律作周期性重复排列,故⑤正确;
⑥根据晶体的构成微粒将晶体分为分子晶体、原子晶体、离子晶体和金属晶体以及混合型晶体,故⑥错误;
⑦干冰晶体中,一个CO2分子周围有12个CO2分子紧邻;CsCl晶体中阴阳离子的配位数为8,NaCl晶体中阴阳离子的配位数为6,所以CsCl和NaCl晶体中阴、阳离子的配位数不同,故⑦错误;
所以不正确的有②③⑥⑦;
答案选D。

练习册系列答案
相关题目