题目内容
【题目】水合草酸亚铁(FeC2O4·xH2O)是生产锂电池的原料。难溶于水,受热易分解。某化学兴趣小组对草酸亚铁的一些性质进行探究。回答下列问题:
(1)将水合草酸亚铁溶于适量盐酸。分别取2 mL此溶液于3支试管中,进行实验。能证明水合草酸亚铁中存在Fe2+的试剂有____(填代号)。
A.KSCN溶液 B.K3[Fe(CN)6]溶液 C.酸性KMnO4溶液
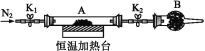
(2) 为测定水合草酸亚铁中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为m2 g。按下图连接好装置进行实验。
实验步骤如下:
a.打开K1和K2,缓缓通入N2; b.低温加热装置A一段时间;
c.停上加热,冷却到室温; d.关闭K1和K2,称量A;
e. ,记为m3 g。
①补充实验步骤e为__________(填实验操作和要求)。
②步骤b至步骤e继续通入N2的目的是___________________。
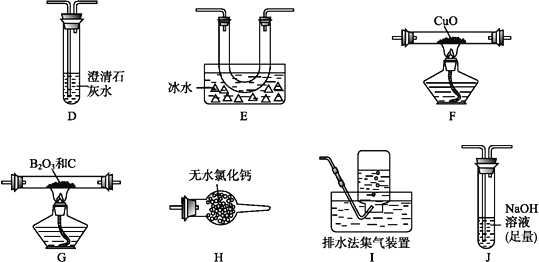
(3)为探究草酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示部分的装置(可重复选用)进行实验。打开K1和K2,缓缓通入N2,充分加热。实验后石英玻璃管中固体仅残留一种有磁性的黑色化合物。
①实验装置中,依次连接的合理顺序为A→_______________。
②证明产物有CO生成的现象是________________。
③写出草酸亚铁受热分解的化学方程式________________。
【答案】B重复上述a~d步骤,直至A恒重。将装置A中的水蒸气带走;同时防止FeC2O4被空气氧化。C→E→C→F→G→C→HG装置黑色固体变红,其后的C中澄清石灰水变浑浊3FeC2O4![]() Fe3O4+4CO↑+2CO2↑
Fe3O4+4CO↑+2CO2↑
【解析】
(1)A. KSCN溶液加到亚铁盐溶液中没有明显的现象,故A错误;B.K3[Fe(CN)6]溶液与亚铁离子反应生成蓝色沉淀,故B正确;C.酸性KMnO4溶液能够被亚铁离子和草酸跟离子还原褪色,不能说明有一定含有亚铁离子,故C错误;故选B;
(2)①实验过程为:a.打开K1和K2,缓缓通入N2;b.低温加热装置A一段时间;c.停上加热,冷却到室温;d.关闭K1和K2,称量A;e.重复上述a~d步骤,直至A恒重;②氮气不参加反应,为保护气体,考虑到实验目的是测定水合草酸亚铁中结晶水含量,所以通入氮气有两个目的;将装置A中的水蒸气带走;同时防止FeC2O4被空气氧化;
(3)①加热分解草酸亚铁生成一氧化碳和二氧化碳,则实验应验证一氧化碳和二氧化碳,先验证二氧化碳,可用澄清石灰水;然后除去二氧化碳、并检验二氧化碳已除尽;接着验证一氧化碳,可用还原氧化铜实验。所以连接装置顺序为: C(验证二氧化碳)→E(除去二氧化碳)→C(验证二氧化碳被除净)→F(干燥气体)→G(验证一氧化碳)→C(验证一氧化碳被氧化成二氧化碳)→H(尾气收集);②证明产物有CO生成的现象是G装置黑色固体变红,其后的C中澄清石灰水变浑浊;③实验后石英玻璃管中固体仅残留一种有磁性的黑色化合物,此黑色化合物为四氧化三铁,因此,加热后草酸亚铁分解,生成物为一氧化碳和二氧化碳和四氧化三铁,该反应的化学方程式为:3FeC2O4![]() Fe3O4+4CO↑+2CO2↑。
Fe3O4+4CO↑+2CO2↑。

 阅读快车系列答案
阅读快车系列答案【题目】下列图中的实验方案,能达到实验目的的是
选项 | 实验方案 | 实验目的 |
A |
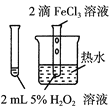
| 验证FeCl3对H2O2分解反应有催化作用 |
B |
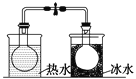
将NO2球浸泡在冰水和热水中 | 探究温度对平衡2NO2 |
C |
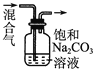
| 除去CO2气体中混有的SO2 |
D |
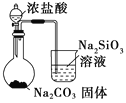
| 比较HCl、H2CO3和H2SiO3的酸性强弱 |
A. A B. B C. C D. D