题目内容
(14分)我国是世界上最大的耗煤国家,但每年占总产量70%的煤都被直接烧掉,既浪费了资源又污染环境。因此开发新能源是国家能源发展的方向。
试回答下列问题:
(1)已知1.12LCH4(标况)完全燃烧生成二氧化碳和液态水,可放出44.5KJ的热量,则其热化学方程式为__________;
(2)人们常用“热值”来衡量燃料燃烧放出的热量的大小。“热值”是指常温常压下,1g物质完全燃烧生成稳定物质放出的热量。则CH4的热值是________KJ.g-1
(3)氢气是一种清洁能源,它不仅热值高,而且原料丰富。氢氧燃料电池是以氢气为燃料,氧气是氧化剂,以氢氧化钾为电解质溶液的燃料电池,试写出正、负极的电极反应式:
正极_______________________ ,负极________________________________.
(4)若以上述氢氧燃料电池作电源,以碳棒为阳极电解100mL饱和食盐水,则阳极的电极反应式为__________________________;当电路中通过0.2mol电子时,阳极可产生的气体____________L(标况下),此时溶液中氢氧化钠的物质的量浓度为________mol.L-1(假设电解前后溶液体积不变).
试回答下列问题:
(1)已知1.12LCH4(标况)完全燃烧生成二氧化碳和液态水,可放出44.5KJ的热量,则其热化学方程式为__________;
(2)人们常用“热值”来衡量燃料燃烧放出的热量的大小。“热值”是指常温常压下,1g物质完全燃烧生成稳定物质放出的热量。则CH4的热值是________KJ.g-1
(3)氢气是一种清洁能源,它不仅热值高,而且原料丰富。氢氧燃料电池是以氢气为燃料,氧气是氧化剂,以氢氧化钾为电解质溶液的燃料电池,试写出正、负极的电极反应式:
正极_______________________ ,负极________________________________.
(4)若以上述氢氧燃料电池作电源,以碳棒为阳极电解100mL饱和食盐水,则阳极的电极反应式为__________________________;当电路中通过0.2mol电子时,阳极可产生的气体____________L(标况下),此时溶液中氢氧化钠的物质的量浓度为________mol.L-1(假设电解前后溶液体积不变).
(1) CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H="-890" KJ.mol-1。
(2) 55.6 (3)O2+4e-+2H2O=4OH-, 2H2-4e-+4OH-=4H2O
(4)2Cl--2e-=Cl2↑;2.24; 2
(2) 55.6 (3)O2+4e-+2H2O=4OH-, 2H2-4e-+4OH-=4H2O
(4)2Cl--2e-=Cl2↑;2.24; 2
(1)考查热化学方程式的书写。1.12LCH4(标况)是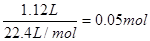 ,所以1mol甲烷燃烧放出的能量是44.5KJ×20=890kJ。
,所以1mol甲烷燃烧放出的能量是44.5KJ×20=890kJ。
(2)1mol甲烷燃烧放出890kJ的能量,所以其热值是 。
。
(3)在燃料电池中可燃物通入负极,失去电子,发生氧化反应。空气或氧气通入正极,得到电子,发生还原反应。
(4)惰性电极电解饱和食盐水时,阳极是氯离子放电,生成氯气,电极反应式为2Cl--2e-=Cl2↑,所以当转移0.2mol电子时,生成0.1mol氯气,标准状况下的体积是2.24L。根据电解的总反应式1NaCl+2H2O 2NaOH+H2↑+Cl2↑可知,氢氧化钠的物质的量是0.2mol,其浓度是
2NaOH+H2↑+Cl2↑可知,氢氧化钠的物质的量是0.2mol,其浓度是 。
。
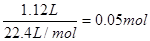 ,所以1mol甲烷燃烧放出的能量是44.5KJ×20=890kJ。
,所以1mol甲烷燃烧放出的能量是44.5KJ×20=890kJ。(2)1mol甲烷燃烧放出890kJ的能量,所以其热值是
 。
。(3)在燃料电池中可燃物通入负极,失去电子,发生氧化反应。空气或氧气通入正极,得到电子,发生还原反应。
(4)惰性电极电解饱和食盐水时,阳极是氯离子放电,生成氯气,电极反应式为2Cl--2e-=Cl2↑,所以当转移0.2mol电子时,生成0.1mol氯气,标准状况下的体积是2.24L。根据电解的总反应式1NaCl+2H2O
 2NaOH+H2↑+Cl2↑可知,氢氧化钠的物质的量是0.2mol,其浓度是
2NaOH+H2↑+Cl2↑可知,氢氧化钠的物质的量是0.2mol,其浓度是 。
。
练习册系列答案
 53天天练系列答案
53天天练系列答案
相关题目
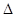 H=-
H=-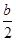 kJ/mol
kJ/mol
 2NO(g) DH=a kJ·mol-1的平衡常数K如下表:
2NO(g) DH=a kJ·mol-1的平衡常数K如下表: