题目内容
乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇的一种反应原理为:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g).下列有关说法正确的是( )
| A、升高温度,平衡逆向移动,说明此反应△H<0 |
| B、H2O分子间不存在氢键 |
| C、CH3CH2OH分子中α键和π键个数比为1:1 |
| D、每生成1mol乙醇转移电子6mol |
考点:化学平衡的影响因素,化学键,含有氢键的物质
专题:基本概念与基本理论
分析:A、依据化学平衡移动原理分析判断;
B、水分子间氧原子和氢原子间形成氢键;
C、CH3CH2OH分子中不含π键;
D、依据化学方程式元素化合价变化,计算电子转移;
B、水分子间氧原子和氢原子间形成氢键;
C、CH3CH2OH分子中不含π键;
D、依据化学方程式元素化合价变化,计算电子转移;
解答:
解:A、反应升高温度,平衡向吸热的反应方向移动,逆向是吸热反应,所以正向为放热,A正确;
B、H2O分子间,氧原子和氢原子间存在氢键,故B错误;
C、CH3CH2OH分子中不含π键,故C错误;
D、2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g),每生成1mol乙醇转移电子12mol,故D错误;
故选A.
B、H2O分子间,氧原子和氢原子间存在氢键,故B错误;
C、CH3CH2OH分子中不含π键,故C错误;
D、2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g),每生成1mol乙醇转移电子12mol,故D错误;
故选A.
点评:本题考查化学平衡、氧化还原反应、物质结构、反应热和化学计量等知识,意在考查同学们的知识记忆能力和判断能力,题目难度中等.

练习册系列答案
相关题目
(双选)下列物质在浓H2SO4作用下能发生消去反应的是( )
| A、CH3OH |
| B、(CH3)3COH |
| C、(CH3)3CCH2OH |
D、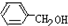 |
E、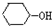 |
下面是四位同学在学习“化学反应的速率和化学平衡”一章后,联系工业生产实际所发表的观点,你认为不正确的是( )
| A、使用冰箱保存食物,是利用了化学反应速率理论 |
| B、化学平衡理论是研究怎样使用有限原料多出产品 |
| C、使用催化剂,可加快反应速率,目的是提高生产效率 |
| D、化学反应速率理论是研究怎样提高原料转化率 |
氰气的化学式为(CN)2,结构式为N≡C-C≡N,性质与卤素相似,下列叙述正确的是( )
| A、该分子不能发生加成反应 |
| B、分子中N≡C键的键长大于C-C键的键长 |
| C、分子中含有3个σ键和4个π键 |
| D、不和氢氧化钠溶液发生反应 |
将一小块钠放入CuSO4溶液中,观察到现象是( )
| A、钠溶解,有Cu析出,并有气体产生 |
| B、钠溶解,有蓝色沉淀,有氢气产生 |
| C、有气体产生,无沉淀产生 |
| D、钠在液面逐渐消失,有气体产生和蓝色沉淀 |
化学与能源开发,环境保护、生产生活等密切相关.下列有关说法正确的是( )
| A、二氧化硫可用于纸浆漂白,表明二氧化硫具有还原性 |
| B、CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 |
| C、明矾可用于净水是因为它能够消毒杀菌 |
| D、静电除尘、血液透析均与胶体性质相关 |
原子序数从11~18的元素,随着核电荷数的递增而逐渐增大的是( )
| A、电子层数 | B、核外电子数 |
| C、原子半径 | D、最外层电子数 |
由黄铁矿炼铜的过程中发生了反应:Cu2S+2Cu2O
6Cu+SO2↑,下列叙述正确的是( )
| ||
| A、该反应从氧化还原反应的电子转移看,与SO2+2H2S═3S+2H2O是同一反应类型 | ||||
| B、该反应中,氧元素氧化了硫元素 | ||||
C、该反应从氧化还原反应的电子转移角度看,与6NO2+8NH3
| ||||
| D、该反应中,Cu2S既是还原剂又是氧化剂 |
现有四种元素的基态原子的电子排布式如下:
①1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p5.则下列有关比较中正确的是( )
①1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p5.则下列有关比较中正确的是( )
| A、第一电离能:③>①>② |
| B、原子半径:③>②>① |
| C、电负性:③>①>② |
| D、最高正化合价:③>②>① |