题目内容
【题目】二氧化氯是高效、低毒的消毒剂。已知:ClO2是极易溶于水的气体,实验室制备及性质探究装置如图所示。回答下列问题:
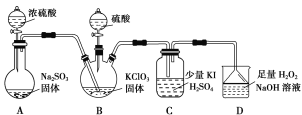
(1)装置B用于制备ClO2,同时还生成一种酸式盐,该反应的化学方程式为___________。装置C中滴有几滴淀粉溶液,反应时有蓝色岀现。淀粉的作用是______。
(2)装置C的导管靠近而不接触液面,其目的是________。
(3)用ClO2消毒自来水,其效果是同质量氯气的______倍(保留一位小数)。
(4)装置D用于吸收尾气,若反应的氧化产物是一种单质,且氧化剂与氧化产物的物质的量之比是2∶1,则还原产物的化学式是___________。
(5)若将装置C中的溶液改为Na2S溶液,通入ClO2后溶液无明显现象。由此可以产生两种假设:
假设a:ClO2与Na2S不反应。
假设b:ClO2与Na2S反应。
①你认为哪种假设正确,阐述原因:___________。
②请设计实验证明你的假设(仅用离子方程式表示):__________。
【答案】SO2+H2SO4+2KClO3=2KHSO4+2ClO2 通过检验I2的存在,证明ClO2有强氧化性 使ClO2尽可能多的与溶液反应,并防止倒吸 2.6 NaClO2 假设b正确, S2-的还原性强于I-,所以ClO2也能氧化S2-或ClO2是强氧化剂,S2-具有强还原性 SO42-+Ba2+=BaSO4↓
【解析】
浓硫酸和亚硫酸钠反应生成二氧化硫,A制备二氧化硫,B用于制备ClO2,同时还生成一种酸式盐,则B中发生反应SO2+H2SO4+2KClO3═2KHSO4+2ClO2,ClO2是一种黄绿色易溶于水的气体,具有强氧化性,所以C中发生氧化还原反应生成碘,注意防倒吸,装置C中滴有几滴淀粉溶液,碘遇淀粉变蓝色;装置D用于吸收尾气,反应生成NaClO2,双氧水作还原剂生成氧气,从而防止尾气污染环境,据此解答。
(1)装置B用于制备ClO2,同时还生成一种酸式盐,根据元素守恒知,酸式盐为硫酸氢钠,该反应的化学方程式为SO2+H2SO4+2KClO3═2KHSO4+2ClO2;装置C中滴有几滴淀粉溶液,淀粉遇碘变蓝色,根据淀粉是否变色来判断是否有碘生成,从而证明二氧化氯具有氧化性;
(2)ClO2是极易溶于水的气体,所以检验其强氧化性时导管靠近而不接触液面,以防倒吸;
(3)1molCl2即71g消毒时转移2mol电子,71gClO2消毒时转移电子为![]() ×(4+1)=5.2mol,其效果是同质量氯气的
×(4+1)=5.2mol,其效果是同质量氯气的![]() =2.6倍;
=2.6倍;
(4)装置D用于吸收尾气,H2O2作还原剂生成O2,H2O2O22e,生成1molO2转移电子2mol,则2molClO2得到2mol电子生成2molNaClO2;
(5)①由于ClO2具有强氧化性,Na2S具有强还原性,二者不可能不反应,所以假设a错误,假设b正确;
②ClO2氧化Na2S后溶液无明显现象,说明ClO2将S2氧化生成更高价的酸根SO42,所以可通过检验SO42的存在以证明ClO2与Na2S发生氧化还原反应,所用试剂为稀盐酸和BaCl2溶液,离子反应为:SO42+Ba2+═BaSO4↓。

【题目】碱式氧化镍(NiOOH)可用作镍氢电池的正极材料,可用废镍催化剂(主要含Ni、Al,少量Cr、FeS 等)来制备,其工艺流程如下:

回答下列问题:
(1)“浸泡除铝”时,发生反应的离子反应方程式为_________________________;
(2)“溶解”时放出的气体为_______________ (填化学式);
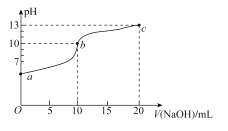
(3)已知该条件下金属离子开始沉淀和完全沉淀的pH如下表:
开始沉淀的pH | 完全沉淀的pH | |
Ni2+ | 6.2 | 8.6 |
Fe2+ | 7.6 | 9.1 |
Fe3+ | 2.3 | 3.3 |
Cr3+ | 4.5 | 5.6 |
“调pH 1”时,溶液pH范围为______________________;
(4)在空气中加热Ni(OH)2可得NiOOH,请写出此反应的化学方程式_____________;

(5)金属铬在溶液中有多种存在形式, CrO42—和Cr2O72—在溶液中可相互转化。室温下,初始浓度为1.0mol/L的Na2CrO4溶液中c(Cr2O72—)随c(H+)的变化如图所示,用离子方程式表示Na2CrO4溶液中的转化反应________________,根据A点数据计算出该转化反应的平衡常数为______________,温度升高,溶液中CrO42—的平衡转化率减小,则该反应的△H____0(填“>”、“<”或“=”)。