题目内容
【题目】25℃,CH3COOH的电离常数Ka=1.75×10-5。
(1)计算0.1 mol·L-1的CH3COOH溶液中c(H+)=__________________;
(2)0.1 mol·L-1的CH3COOH和0.1 mol·L-1的CH3COONa的混合溶液中,c(H+)=_____________;
(3)25°C,将0.1 mol·L-1的CH3COOH溶液加水稀释,请填写下列表达式中的数据情况(填“变大”、“变小”或“不变”)。
①![]() =____________;
=____________;
②![]() =____________;
=____________;
③![]() =____________;
=____________;
④![]() =____________。
=____________。
【答案】1.32×10-3 mol·L-1 1.75×10-5 mol·L-1 变小 不变 变大 不变
【解析】
0.1 mol/L醋酸溶液中,存在电离平衡CH3COOH![]() H++CH3COO-
H++CH3COO-
(1)CH3COOH是弱酸,存在电离平衡,可用三段式计算,设溶液中H+浓度为![]() ,
,
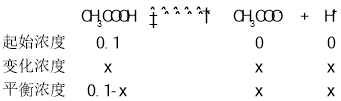
根据Ka=![]() 带入数据,x=1.32×10-3 mol·L-1,则0.1 mol·L-1的CH3COOH溶液中c(H+)=1.32×10-3 mol·L-1。
带入数据,x=1.32×10-3 mol·L-1,则0.1 mol·L-1的CH3COOH溶液中c(H+)=1.32×10-3 mol·L-1。
(2)0.1 mol·L-1的CH3COOH和0.1 mol·L-1的CH3COONa的混合溶液中, 设溶液中H+浓度为![]() ,列三段式如下
,列三段式如下
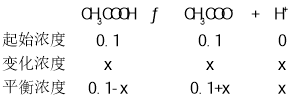
Ka=![]() ,x=1.75×10-5 mol·L-1 则c(H+)=1.75×10-5 mol·L-1
,x=1.75×10-5 mol·L-1 则c(H+)=1.75×10-5 mol·L-1
(3)将①做如下改变,![]() =
=![]() ,Ka在稀释过程中不变,
,Ka在稀释过程中不变,![]() 减小,则①表达式数据变小;
减小,则①表达式数据变小;
②![]() =Ka,Ka只与温度有关,所以②表达式数据不变;
=Ka,Ka只与温度有关,所以②表达式数据不变;
③![]() =
=![]() ,Ka在稀释过程中不变,
,Ka在稀释过程中不变,![]() 减小,则③表达式数据变大;
减小,则③表达式数据变大;
④![]() ,Ka及KW在稀释过程中不变,则④表达式数据不变。
,Ka及KW在稀释过程中不变,则④表达式数据不变。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目