题目内容
17.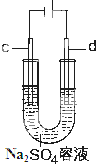 在25℃时,将一根石墨棒和一根铁棒做两电极分别插入一定量的硫酸钠饱和溶液中进行电解(见图),
在25℃时,将一根石墨棒和一根铁棒做两电极分别插入一定量的硫酸钠饱和溶液中进行电解(见图),(1)通电时,溶液中的Na+、H+(填离子的化学式)移动向c极.
(2)若要使铁棒变细,则d极的电极材料是铁(填“石墨”或“铁”).
(3)若c极是铁棒,①d极上的电极反应为4OH--4e-═2H2O+O2↑.
②总反应的化学方程式为2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑.
③通电一段时间后,若阴极逸出amol气体,同时有bgNa2SO4•10H2O晶体析出,则剩余溶液中溶质的质量分数为$\frac{7100b}{161(b+18a)}$%.
分析 (1-2)将一根石墨棒和一根铁棒做两电极分别插入一定量的硫酸钠饱和溶液中进行电解,根据电解图可知与负极相连的c极为阴极得电子发生还原反应,与正极相连的d极为阳极失电子发生氧化反应;
(3)电解饱和硫酸钠溶液时,本质是电解水,发生反应2H2O$\frac{\underline{\;电解\;}}{\;}$O2↑+2H2↑,电解水后,溶液中硫酸钠过饱和导致析出晶体,剩余的电解质溶液仍是饱和溶液,析出的硫酸钠晶体和电解的水组成的也是饱和溶液,根据质量分数公式计算即可.
解答 解:(1)通电时,与负极相连的c极为阴极,则溶液中的Na+、H+移动向c极,故答案为:Na+、H+.
(2)若要使铁棒变细,即铁作阳极,所以与正极相连的d极电极材料是铁,故答案为:铁.
(3)若c极是铁棒,①d极为石墨棒,则溶液中的氢氧根失电子发生氧化反应,反应为4OH--4e-═2H2O+O2↑,故答案为:4OH--4e-═2H2O+O2↑;
②c极是铁棒,则阴极上为氢离子得电子发生还原反应,反应为4H++4e-═2H2↑,所以总反应即为电解水,化学方程式为2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑,故答案为:2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑;
③电解饱和硫酸钠溶液时,本质是电解水,发生反应2H2O$\frac{\underline{\;电解\;}}{\;}$O2↑+2H2↑,电解水后,溶液中硫酸钠过饱和导致析出晶体,剩余的电解质溶液仍是饱和溶液,析出的硫酸钠晶体和电解的水组成的也是饱和溶液,
bgNa2SO4•10H2O硫酸钠的质量=bg×$\frac{142}{322}$=$\frac{71b}{161}$g;
设电解水的质量为x:
2H2O$\frac{\underline{\;电解\;}}{\;}$O2↑+2H2↑
36g 2mol
x amol
解得:x=18ag
所以饱和溶液的质量分数=$\frac{\frac{71b}{161}}{b+18a}$×100%=$\frac{7100b}{161(b+18a)}$%,故答案为:$\frac{7100b}{161(b+18a)}$%.
点评 本题以电解原理为载体考查了质量分数的计算,难度较大.明确电解后析出的硫酸钠晶体和电解的水组成的是饱和溶液是解本题的关键.

 教材全解字词句篇系列答案
教材全解字词句篇系列答案| A. | 2 min | B. | 3 min | C. | 6 min | D. | 9 min |
有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体[ | 无色液体 |
| 密度/g/cm3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -1l6 |
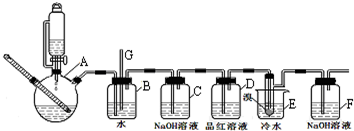
(1)实验开始之前必要的操作是检查装置的气密性.
(2)A中反应的化学方程式CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O.
(3)实验过程中,若发现装置B中水沿导管G上升,则需进行的操作是停止加热,向烧杯E中加适量温水.
(4)装置D中品红溶液的作用是验证二氧化硫是否被除尽.
(5)反应过程中应用冷水冷却装置E,其主要目的是减少液溴挥发.
(6)判断该制备反应已经结束的最简单方法是装置E中小试管内的液体由红棕色变为无色;结果学生发现反应结束时,无水乙醇消耗量大大超过理论值,其原因是有副反应发生或反应过于剧烈,一部分乙烯没有充分反应就逸出(答出其中两条即可).
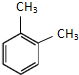
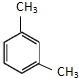
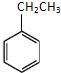
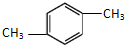
| A. | 相同的分子式 | B. | 相同的结构 | ||
| C. | 相似的化学性质 | D. | 相同的相对分子质量 |
| A. | CH3CH2OH | B. | CH3CH2CH2OH | C. | CH3OH | D. | CH3CH2CH(CH3)OH |