题目内容
【题目】氮的氧化物(如NO2、NO4、N2O5等)应用很广,在一定条件下可以相互转化.
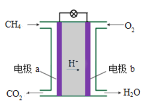
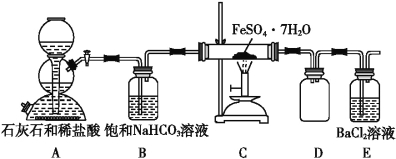
(1)从N2O5可通过电解或臭氧氧化N2O4的方法制备.电解装置如图1所示(隔膜用于阻止水分子通过),其阳极反应式为___ .

己知:2NO(g)+O2(g)═2NO2(g)△H1
NO(g)+O3(g)═NO2(g)+O2(g)△H2
2NO2(g)N2O4(g)△H3
2N2O5(g)═4NO2(g)+O2(g)△H4
则反应N2O4(g)+O3(g)═N2O5(g)+O2(g)的△H=___ .
(2)从N2O5在一定条件下发生分解:2N2O5(g)═4NO2(g)+O2(g).某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
c(N2O5)/mol/L | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
设反应开始时体系压强为p0 , 第2.00min时体系压强为p,则p:p0=___ ;1.00~3.00min内,O2的平均反应速率为___ .
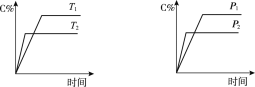
(3)从N2O4与NO2之间存在反应N2O42NO2(g).将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度变化如图1所示.
①图中a点对应温度下,已知N2O4的起始压强p0为108kPa,列式计算该温度下反应的平衡常数Kp=___ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
②由图推测N2O4(g)2NO2(g)是吸热反应还是放热反应,说明理由___ ,若要提高N2O4转化率,除改变反应温度外,其他措施有___ (要求写出两条).
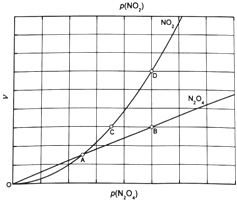
③对于反应N2O4(g)2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强间存在关系:v(N2O4)=k1p(N2O4),v(NO2)=k2[p(NO2)]2 . 其中,kl、k2是与反应及温度有关的常数.相应的速率一压强关系如图所示:一定温度下,kl、k2与平衡常数Kp的关系是kl=___ ,在图标出的点中,指出能表示反应达到平衡状态的点并说明理由___ .
【答案】N2O4+2HNO3﹣2e﹣═2N2O5+2H+ △H=△H2﹣![]() △H1﹣△H3﹣
△H1﹣△H3﹣![]() △H4 1.75 0.090mol/(L·min) 115.2 吸热反应,温度升高,α(N2O4)增加,说明平衡右移 减小体系压强、移出NO2
△H4 1.75 0.090mol/(L·min) 115.2 吸热反应,温度升高,α(N2O4)增加,说明平衡右移 减小体系压强、移出NO2 ![]() B点与D点,满足平衡条件υ(NO2)=2υ(N2O4)
B点与D点,满足平衡条件υ(NO2)=2υ(N2O4)
【解析】
根据化合价的变化判断电极反应,写出电极反应式;应用盖斯定律求目标反应的反应热。恒温恒容时由气体物质的量之比求压强之比,再由定义求化学反应速率。据分压、压力常数、速率方程等信息,解决实际问题。
(1)电解N2O4(N+4价)制备N2O5(N+5价),故阳极为N2O4失电子,阳极反应式为N2O4+2HNO3﹣2e﹣═2N2O5+2H+。
将已知和所求热化学方程式编号为
①2NO(g)+O2(g)═2NO2(g) △H1
②NO(g)+O3(g)═NO2(g)+O2(g) △H2
③2NO2(g)N2O4(g) △H3
④2N2O5(g)═4NO2(g)+O2(g) △H4
⑤N2O4(g)+O3(g)═N2O5(g)+O2(g) △H
因为⑤=②-![]() ①-③-
①-③-![]() ④,则有△H=△H2﹣
④,则有△H=△H2﹣![]() △H1﹣△H3﹣
△H1﹣△H3﹣![]() △H4
△H4
(2)
恒温、恒容: 2N2O5(g)═4NO2(g)+O2(g)
起始/mol·L-1: 1.00 0 0
转化/mol·L-1: 0.50 1.00 0.25
2min末/mol·L-1: 0.50 1.00 0.25
体系压强之比p:p0=(0.50+1.00+0.25):1.00=1.75。
1.00~3.00min内,v(O2)=![]() v(N2O5)=
v(N2O5)=![]() = 0.090mol/(L·min)。
= 0.090mol/(L·min)。
(3)①设起始时N2O4为1.00mol/L,平衡时总压强为p。
a点、恒容: N2O4 (g) 2NO2(g)
起始/mol·L-1: 1.00 0
转化/mol·L-1: 0.40 0.80
平衡/mol·L-1: 0.60 0.80
则p:108kPa=(0.60+0.80):1.00,p=108kPa×1.4。N2O4分压为108kPa×0.6=64.8kPa,NO2分压为108kPa×0.8=86.4kPa。该温度下反应的平衡常数Kp=(86.4kPa)2/64.8kPa=115.2。
②由图可知,升高温度N2O4平衡转化率增大,即平衡右移,正反应吸热。要提高N2O4转化率,可从平衡体系中分离出,使平衡右移;或扩大容器体积,使平衡右移。
③据题意,v(N2O4)、v(NO2)分别表示正、逆反应速率,当v(N2O4): v(NO2)=1:2时为化学平衡状态,此时k1p(N2O4):k2[p(NO2)]2=1:2,得k1=![]() 。
。
图中满足v(N2O4): v(NO2)=1:2关系的点为化学平衡。在A、B、C、D四点中,B与D是化学平衡状态。