题目内容
【题目】X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示。若Y原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是 ( )

A. 原子半径:Z> W>X>Y
B. 氧化物对应水化物的酸性:W>Z>X
C. 四种元素氢化物的沸点:W> Z>Y>X
D. 四种元素对应阴离子的还原性:W> Z>Y>X
【答案】A
【解析】
Y原子的最外层电子数是次外层电子数的3倍可知,Y的次外层电子数为2,最外层电子数为6,Y为氧元素,根据元素在周期表中的位置关系可以推出:X为N元素,Z为S元素,W为Cl元素。再根据元素周期性分析判断。
A.同一周期,从左到右,原子半径逐渐减小,故X>Y,Z>W,同一主族,从上到下,原子半径逐渐增大,故Z>Y,故原子半径:Z>W>X>Y,故A正确;
B.同一周期,从左到右,最高价氧化物对应水化物的酸性逐渐增强,但其他氧化物对应水化物的酸性不满足此规律,如次氯酸为弱酸,而硫酸为强酸,故B错误;
C.水分子间能够形成氢键,沸点比硫化氢高,即氢化物的沸点存在:Y > Z,故C错误;
D.元素的非金属性越强,对应阴离子的还原性越弱,阴离子的还原性: Z> W,故D错误;
答案选A。

【题目】下表是元素周期表的一部分,针对表中的①~⑨九种元素,填写下列空白:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
二 | ① | ② | ③ | |||||
三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
四 | ⑨ |
(1)在这些元素中,化学性质最不活泼的是________(填具体元素符号,下同)。
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是________,碱性最强的化合物的电子式是____________,其含有的化学键类型___________
(3)最高价氧化物是两性氧化物的素是________;写出它的氧化物与盐酸反应的离子方程式_________________________________________
(4)写出元素③的氢化物的电子式______________
(5)写出④的单质与水反应的离子方程式________________________________________
【题目】氮的氧化物(如NO2、NO4、N2O5等)应用很广,在一定条件下可以相互转化.
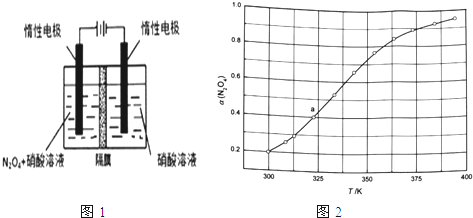
(1)从N2O5可通过电解或臭氧氧化N2O4的方法制备.电解装置如图1所示(隔膜用于阻止水分子通过),其阳极反应式为___ .
己知:2NO(g)+O2(g)═2NO2(g)△H1
NO(g)+O3(g)═NO2(g)+O2(g)△H2
2NO2(g)N2O4(g)△H3
2N2O5(g)═4NO2(g)+O2(g)△H4
则反应N2O4(g)+O3(g)═N2O5(g)+O2(g)的△H=___ .
(2)从N2O5在一定条件下发生分解:2N2O5(g)═4NO2(g)+O2(g).某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
c(N2O5)/mol/L | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
设反应开始时体系压强为p0 , 第2.00min时体系压强为p,则p:p0=___ ;1.00~3.00min内,O2的平均反应速率为___ .
(3)从N2O4与NO2之间存在反应N2O42NO2(g).将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度变化如图1所示.
①图中a点对应温度下,已知N2O4的起始压强p0为108kPa,列式计算该温度下反应的平衡常数Kp=___ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
②由图推测N2O4(g)2NO2(g)是吸热反应还是放热反应,说明理由___ ,若要提高N2O4转化率,除改变反应温度外,其他措施有___ (要求写出两条).
③对于反应N2O4(g)2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强间存在关系:v(N2O4)=k1p(N2O4),v(NO2)=k2[p(NO2)]2 . 其中,kl、k2是与反应及温度有关的常数.相应的速率一压强关系如图所示:一定温度下,kl、k2与平衡常数Kp的关系是kl=___ ,在图标出的点中,指出能表示反应达到平衡状态的点并说明理由___ .