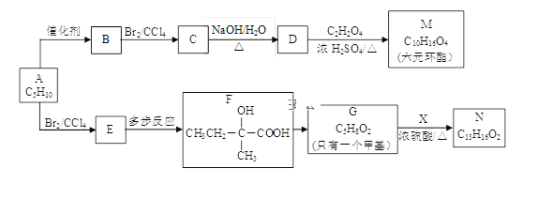
题目内容
【题目】某实验小组欲制取 NaHSO3 晶体,设计采用如下装置制备(省略夹持和加热装置)。
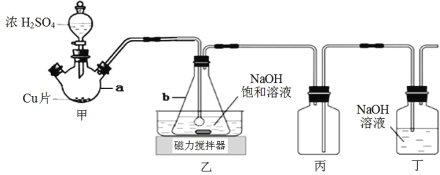
(1)仪器 b 的名称是_____________。
(2)装置丙的作用是_____________。
(3)装置乙中过量的 SO2 与 NaOH 溶液反应生成 NaHSO3 晶体,其离子方程式为_____________。
(4)装置甲中反应生成 SO2 的操作顺序是_____________。
①点燃酒精灯加热仪器 a
②打开分液漏斗上口玻璃塞
③打开分液漏斗玻璃旋塞,使浓硫酸流入 a
④关闭分液漏斗玻璃旋塞
(5)经检验,实验制得的 NaHSO3 晶体中含有大量的 Na2S2O5 固体和一定量的 Na2SO3 和Na2SO4,查阅资料获知在溶液中 NaHSO3 易发生反应生成 Na2S2O5,Na2S2O5 在空气中、受热时均易分解。
①试写出反应生成 Na2S2O5 的化学方程式_____________。
②晶体中含有 Na2SO3 和 Na2SO4 的可能原因是_____________。
【答案】锥形瓶 安全瓶,防止倒吸 SO2+Na++OH-═NaHSO3↓ ②③④① 2NaHSO3═Na2S2O5+H2O Na2S2O5分解生成生Na2SO3,Na2SO3被氧化生成Na2SO4
【解析】
(1)根据常见仪器的名称结合该仪器的特征解答;
(2)根据图示可知气体通过一个集气瓶再与液体接触,发生倒吸时,液体会进入集气瓶中,从而从导气管进入左侧的集气瓶,据此分析用途;
(3)装置乙中过量的SO2与NaOH溶液反应生成NaHSO3晶体,NaHSO3晶体为沉淀,根据方程式书写;
(4)装置甲中反应生成SO2,先将分液漏斗上的玻璃塞打开或使塞上的凹槽对准漏斗口上的小孔,保证压强上下一样,后打开分液漏斗玻璃旋塞,关闭分液漏斗玻璃旋塞后,再点燃酒精灯加热仪器a,防止生成的二氧化硫从上口逸出;
(5)①在溶液中NaHSO3易发生反应生成Na2S2O5,根据原子守恒还有水生成;
②Na2S2O5在空气中.受热时均易分解,亚硫酸钠中+4价的硫易被氧化成+6价。
(1)该仪器外观呈平底圆锥状,下阔上狭,有一圆柱形颈部,上方有一较颈部阔的开口,为锥形瓶,
故答案为:锥形瓶;
(2)二氧化硫极易溶于NaOH溶液,易发生倒吸,图示可知二氧化硫气体通过一个集气瓶再与NaOH溶液接触,发生倒吸时,液体会进入集气瓶中,从而从导气管进入左侧的集气瓶,所以装置丙的作用是安全瓶,防止倒吸,
故答案为:安全瓶,防止倒吸;
(3)乙装置:二氧化硫与氢氧化钠反应生成亚硫酸氢钠,反应为:SO2+NaOH═NaHSO3↓,其离子方程式为:SO2+Na++OH-═NaHSO3↓,
故答案为:SO2+Na++OH-═NaHSO3↓;
(4)装置甲中反应生成SO2,放出液体时,应打开上口玻璃塞或将玻璃塞上的凹槽对准漏斗口上的小孔使分液漏斗内外大气相通,便于液体流出,选②,打开分液漏斗玻璃旋塞,使浓硫酸流入a,选③,后打开分液漏斗玻璃旋塞,关闭分液漏斗玻璃旋塞后选④,再点燃酒精灯加热仪器a选①,防止生成的二氧化硫从上口逸出,所以操作顺序是②③④①,
故答案为:②③④①;
(5)①在溶液中NaHSO3易发生反应生成Na2S2O5,根据原子守恒产物还有水,反应为:2NaHSO3═Na2S2O5+H2O,
故答案为:2NaHSO3═Na2S2O5+H2O;
②Na2S2O5在空气中.受热时均易分解,分解生成生Na2SO3,晶体中含有Na2SO3,Na2SO3被氧化生成Na2SO4,
故答案为:Na2S2O5分解生成生Na2SO3,Na2SO3被氧化生成Na2SO4。

 金钥匙试卷系列答案
金钥匙试卷系列答案