题目内容
【题目】某天然碱可以看作是CO2 和 NaOH 反应后的产物组成的一种物质。为了研究该物质的组成,进行如下实验:
ⅰ称取 3.98 g 天然碱样品,加入 50mL 稀盐酸(足量),产生 CO2 896mL(标准状况)。
ⅱ称取 3.98g 天然碱样品,加热至分解完全,产生 CO2 224mL(标准状况)和 0.36g 水。
①该稀盐酸的物质的量浓度最小是_____________。
②天然碱的化学式是_____________。
【答案】1.2mol/L 2Na2CO32NaHCO3H2O
【解析】
天然碱加热分解生成CO2,说明含有NaHCO3,NaHCO3分解生成的CO2.H2O的物质的量相等,而实际分解生成的水比二氧化碳的多,说明天然碱还含有结晶水。相同质量的天然碱加入足量盐酸,生成CO2的体积大于加热分解生成的CO2的体积,说明还含有Na2CO3;
①根据分解生成二氧化碳条件可以计算碳酸氢钠的物质的量,由加酸生成二氧化碳体积,根据碳原子守恒计算碳酸钠的物质的量,加入的盐酸恰好反应时盐酸的物质的量浓度最小,此时溶液中溶质为NaCl,根据钠离子、氯离子守恒计算HCl的物质的量,进而计算盐酸的最小浓度;
②计算天然碱中碳酸钠、碳酸氢钠、结晶水的物质的量比例关系,可得天然碱的化学式。
天然碱加热分解生成CO2,说明含有NaHCO3,分解生成的CO2为![]() =0.01mol,分解生成H2O为
=0.01mol,分解生成H2O为![]() =0.02mol,由2NaHCO3
=0.02mol,由2NaHCO3![]() Na2CO3+CO2↑+H2O可知,天然碱还含有结晶水,相同质量的天然碱加入足量盐酸,生成CO2的体积大于加热分解生成的CO2的体积,说明还含有Na2CO3。
Na2CO3+CO2↑+H2O可知,天然碱还含有结晶水,相同质量的天然碱加入足量盐酸,生成CO2的体积大于加热分解生成的CO2的体积,说明还含有Na2CO3。
①分解生成二氧化碳为0.01mol,则碳酸氢钠为0.01mol×2=0.02mol。加酸生成二氧化碳总物质的量为:![]() =0.04mol,由碳原子守恒可知,碳酸钠物质的量为:0.04mol-0.02mol=0.02mol。加入的盐酸恰好反应时盐酸的物质的量浓度最小,此时溶液中溶质为NaCl,根据钠离子.氯离子守恒:n(HCl)=n(NaCl)=0.02mol×2+0.02mol=0.05mol,故盐酸的最小浓度为:
=0.04mol,由碳原子守恒可知,碳酸钠物质的量为:0.04mol-0.02mol=0.02mol。加入的盐酸恰好反应时盐酸的物质的量浓度最小,此时溶液中溶质为NaCl,根据钠离子.氯离子守恒:n(HCl)=n(NaCl)=0.02mol×2+0.02mol=0.05mol,故盐酸的最小浓度为:![]() =1.2mol/L,
=1.2mol/L,
故答案为:1.2mol/L;
②由方程式可知碳酸氢钠分解生成水为0.01mol,故结晶水的物质的量为0.02mol-0.01mol=0.01mol,则n(Na2CO3):n(NaHCO3):n(H2O)=0.02mol:0.02mol:0.01mol=2:2:1,故该天然碱的组成为:2Na2CO32NaHCO3H2O,
故答案为:2Na2CO32NaHCO3H2O。

 阅读快车系列答案
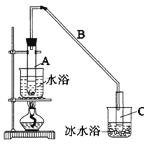
阅读快车系列答案【题目】某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯。
已知: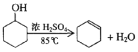
密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环已醇 | 0.96 | 25 | 161 | 能溶于水 |
环已烯 | 0.81 | -103 | 83 | 难溶于水 |
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入lmL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是:_______________,导管B除了导气外还具有的作用是:_______________。
②试管C置于冰水浴中的目的是。:_______________
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在:_______________层(填上或下),分液后用:_______________ (填入编号)洗涤。
a.KMnO4溶液b.稀H2SO4c.Na2CO3溶液