题目内容
19. 已知A,B,C,D,E五种元素的原子序数依次递增,A,B,C,D位于前三周期,A位于周期表的s区,其原子中电子层数和和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B二种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.
已知A,B,C,D,E五种元素的原子序数依次递增,A,B,C,D位于前三周期,A位于周期表的s区,其原子中电子层数和和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B二种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.请回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)E的基态原子的外围电子排布式为1s22s22p63s23p63d24s2.
(2)下列叙述正确的是ad.(填字母)
a.M与水分子间能形成氢键,N是非极性分子
b.M和二氧化碳分子中的中心原子均采用sp2杂化
c.N分子中含有6个σ键和1个π键
d.BD2晶体的熔点、沸点都比二氧化硅晶体的低
(3)E的一种氧化物Q,其晶胞结构如图所示,则Q的化学式为TiO2,该晶体中氧的配位数为3.
分析 A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期,A位于周期表的s区,其原子中电子层数和和未成对电子数相同,则A为氢元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,原子核外电子数排布为1s22s22p2,故B为碳元素;D原子的核外成对电子数是未成对电子数的3倍,核外电子排布为1s22s22p4,故D为氧元素;C原子序数介于碳、氧之间,故C为氮元素;A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,该气体M为HCHO;A、B二种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂,则N为苯;E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同,E原子核外电子数为18+4=22,故E为Ti,据此解答.
解答 解:A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期,A位于周期表的s区,其原子中电子层数和和未成对电子数相同,则A为氢元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,原子核外电子数排布为1s22s22p2,故B为碳元素;D原子的核外成对电子数是未成对电子数的3倍,核外电子排布为1s22s22p4,故D为氧元素;C原子序数介于碳、氧之间,故C为氮元素;A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,该气体M为HCHO;A、B二种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂,则N为苯;E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同,E原子核外电子数为18+4=22,故E为Ti.
(1)E为Ti元素,原子核外电子数为22,基态原子的外围电子排布式为:1s22s22p63s23p63d24s2,
故答案为:1s22s22p63s23p63d24s2;
(2)a.HCHO中O氧原子电负性很大,能与与水分子形成氢键,N为苯,是非极性分子,故a正确;
b.HCHO中C原子形成3个σ键,没有孤电子对,碳原子采用sp2杂化,二氧化碳分子为直线型结构,碳原子采用sp杂化,故b错误;
c.苯分子中H-C之间是s-sp2形成的σ键,C-C之间是sp2形成的σ键,苯分子中含有12个σ键和1个大π键,故c错误;
d.CO2属于分子晶体,二氧化硅属于原子晶体,二氧化碳的熔点、沸点都比二氧化硅晶体的低,故d正确,
故选:ad;
(3)晶胞中Ti原子数目为1+8×$\frac{1}{8}$=2,氧原子数目为2+4×$\frac{1}{2}$=4,故氧化物Q的化学式为TiO2,晶胞内部氧原子周围有3个Ti原子,该晶体中氧的配位数为3,
故答案为:TiO2;3.
点评 本题是对物质结构的考查,推断元素是解题关键,需要学生具备扎实的基础,难度中等.

 天天练口算系列答案
天天练口算系列答案| A. | Na2A溶液中:c(Na+)>c(A2-)>c (HA-)>c(H2A) | |
| B. | NaHA溶液中:c(Na+)=c(A2-)+c(HA-) | |
| C. | Na2A溶液中:c(OH-)=c(H+)+c(HA-)+2c(H2A) | |
| D. | 室温下0.1mol/L的H2A溶液pH大于1 |
| A. | 乙酸分子中有两个碳原子 | |
| B. | 乙酸分子是由一个乙基和一个羧基构成 | |
| C. | 乙酸分子的官能团是羧基 | |
| D. | 乙酸分子中含有一个羟基 |
| A. | 乙醇在水溶液中能电离出少量的H+,所以乙醇是电解质 | |
| B. | 乙醇与O2发生不完全燃烧反应生成乙醛 | |
| C. | 乙醇分子所有的氢原子都可被置换出来 | |
| D. | 乙醇是一种很好的溶剂,能溶解许多无机化合物和有机化合物 |
| A. | 0.1mol•L-1的(NH4)2SO4溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-) | |
| B. | 0.1 mol•L-1 NaHS溶液中:c(H2S)+c(H+)=c(OH-)+c(S2-) | |
| C. | 将pH=2的盐酸和pH=12的氨水等体积混合后的溶液中:c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| D. | 0.1 mol•L-1 NH4HSO4溶液与0.1 mol•L-1 NaOH溶液等体积混合后的溶液中:c(Na+)>c(NH4+)>c(SO42-) |
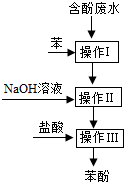
| A. | 操作I中苯作萃取剂 | |
| B. | 苯酚钠在苯中的溶解度比在水中的大 | |
| C. | 通过操作II苯可循环使用 | |
| D. | 三步操作均需要分液漏斗 |
| A. | H2O2 | B. | CHCl3 | C. | HBr | D. | HCN |
 由Cu、Zn、稀H2S04形成如下图甲、乙装置.试回答以下问題:
由Cu、Zn、稀H2S04形成如下图甲、乙装置.试回答以下问題: