题目内容
12.某二元酸H2A的电离方程式为:H2A=H++HA-;HA-?A2-+H+.下列说法正确的是( )| A. | Na2A溶液中:c(Na+)>c(A2-)>c (HA-)>c(H2A) | |
| B. | NaHA溶液中:c(Na+)=c(A2-)+c(HA-) | |
| C. | Na2A溶液中:c(OH-)=c(H+)+c(HA-)+2c(H2A) | |
| D. | 室温下0.1mol/L的H2A溶液pH大于1 |
分析 据H2A的电离方程式可知,其第一步完全电离,第二步电离可逆,则A2-能够水解,HA-只能够电离不能水解,据此分析.
解答 解:A、Na2A溶液中不存在H2A分子,故A错误;
B、据物料守恒,NaHA溶液中c(Na+)=c(A2-)+c(HA-),故B正确;
C、据质子守恒,Na2A溶液中:c(OH-)=c(H+)+c(HA-),溶液中不存在H2A分子,故C错误;
D、据H2A的电离方程式可知,其第一步完全电离,第二步电离可逆,所以室温下0.1mol/L的H2A溶液pH小于1,故D错误;
故选B.
点评 本题考查弱电解质的电离平衡,涉及离子浓度大小比较,做题中注意利用电荷守恒、质量守恒、物料守恒解答此类题目.

练习册系列答案
相关题目
5.下列关于化学用语的表示正确的是( )
| A. | 水合氢离子的电子式: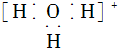 | B. | 氯离子的结构示意图: | ||
| C. | 中子数为28的钙原子:2028Ca | D. | 聚丙烯的结构简式: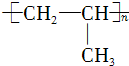 |
3.设NA为阿伏加德罗常数的值,则下列说法正确的是( )
| A. | 电解精炼铜时,若阳极质量减少6.4 g,则电路中转移电子数为0.2NA | |
| B. | 向NH4Al(SO4)2稀溶液中逐滴加入过量Ba(OH)2溶液,离子方程式为:NH4++Al3++2SO42-+2Ba2++5OH-=2BaSO4↓+AlO2-+2H2O+NH3•H2O | |
| C. | 常温下,由水电离出的H+浓度为10-13mol•L-1的溶液中,Fe2+、Cl-、Na+、NO3-可能大量共存 | |
| D. | 葡萄糖(C6H12O6)溶液中:SO42-、MnO4-、K+、H+可以大量共存 |
7.下列说法正确的是( )
| A. | 重结晶法提纯苯甲酸时,为了析出更多晶体,热滤液要用冰盐水充分冷却 | |
| B. | 自然界中无游离态的Na、K、Si、Fe,有游离态的S、O | |
| C. | PM2.5是指大气中直径小于或等于2.5微米的颗粒物,也称为“细颗粒物”,PM2.5在空气中不可能形成胶体 | |
| D. | 硅石、玛瑙、硅胶的主要成分是二氧化硅 |
1.下列有关化学用语使用正确的是( )
| A. | 次氯酸的电子式: | |
| B. | 乙烯的结构简式:CH2CH2 | |
| C. | S2-离子的结构示意图: | |
| D. | CS2的与CO2都是直线型分子,则CS2的比例模型为 |
 研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义.
研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义. (1)与铜同周期、基态原子最外层电子数相同的过渡元素,其基态原子的电子排布式[Ar]3d54s1.
(1)与铜同周期、基态原子最外层电子数相同的过渡元素,其基态原子的电子排布式[Ar]3d54s1. 已知A,B,C,D,E五种元素的原子序数依次递增,A,B,C,D位于前三周期,A位于周期表的s区,其原子中电子层数和和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B二种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.
已知A,B,C,D,E五种元素的原子序数依次递增,A,B,C,D位于前三周期,A位于周期表的s区,其原子中电子层数和和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B二种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.