题目内容
12.下列物质分类正确的是( )| A. | SO2、SiO2、NO2均为酸性氧化物 | B. | 稀豆浆、硅酸、氯化铁溶液均为胶体 | ||
| C. | 烧碱、冰醋酸、四氯化碳均为电解质 | D. | 汽油、水玻璃、氨水均为混合物 |
分析 A、酸性氧化物是指和碱反应生成盐和水的氧化物,一氧化碳是不成盐氧化物;
B、胶体是分散质直径在1-100nm的分散系,硅酸是沉淀,氯化铁溶液不是胶体;
C、电解质是水溶液中或熔融状态能导电的化合物;
D、不同物质组成的物质为混合物.
解答 解:A、SO2、SiO2和碱反应生成盐和水,均为酸性氧化物,NO2和碱反应生成盐和水还有其他物质生成,不是酸性氧化物,故A错误;
B、稀豆浆属于胶体、硅酸是难溶的沉淀、氯化铁溶液不是胶体,分散质微粒直径不同是分散系的本质区别,故B错误;
C、烧碱是氢氧化钠水溶液中完全电离是强电解质、冰醋酸水溶液中部分电离是弱电解质、四氯化碳水溶液中或熔融状态都不导电属于非电解质,故C错误;
D、汽油属于混合物、水玻璃是硅酸钠水溶液,属于混合物、氨水氨气溶于水形成的溶液属于混合物,所以均为混合物,故D正确;
故选D.
点评 本题考查了氧化物分类,分散系的区分,电解质的判断,混合物的物质组成,题目较简单.

练习册系列答案
相关题目
3.超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层.科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2的化学方程式如下:2NO+2CO$\stackrel{催化剂}{→}$2CO2+N2
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
请回答:以下各题(均不考虑温度变化对催化效率的影响):
(1)在上述条件下反应能够自发进行,则反应的△H<0(填写“>”、“<”、“=”).
(2)前2s内的平均反应速度v(N2)=1.875×10-4mol/L•s.
(3)假设在容器中发生上述反应,达到平衡时下列能提高NO转化率的是CD.
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(4)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率.为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中.
①请在空格----中填入剩余的实验条件数据.
②请在给出的坐标图中,画出表中的Ⅱ、Ⅲ两个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线的实验编号.(见答题纸)
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol•L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol•L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
(1)在上述条件下反应能够自发进行,则反应的△H<0(填写“>”、“<”、“=”).
(2)前2s内的平均反应速度v(N2)=1.875×10-4mol/L•s.
(3)假设在容器中发生上述反应,达到平衡时下列能提高NO转化率的是CD.
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(4)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率.为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中.
| 实验编号 | T/℃ | NO初始浓度/ mol•L-1 | CO初始浓度/ mol•L-1 | 催化剂的比表面积/m2•g-1 |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 280 | 1.2×10-3 | 5.8×10-3 | 124 |
| Ⅲ | 350 | 1.2×10-3 | 5.8×10-3 | 124 |
②请在给出的坐标图中,画出表中的Ⅱ、Ⅲ两个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线的实验编号.(见答题纸)
3.下列说法中,正确的是( )
| A. | 两种物质的组成元素相同,各元素的质量分数也相同,则两者一定互为同分异构体 | |
| B. | 分子式为CnH2n的化合物,可能使酸性KMnO4溶液褪色,也可能不使其褪色 | |
| C. | 通式相同,分子组成上相差一个或若干个CH2原子团的化合物,一定互为同系物 | |
| D. | 凡含有苯环的物质都是芳香烃 |
20.下列说法正确的是( )
| A. | 石油经过分馏及裂化等方法得到的物质均为纯净物 | |
| B. | 乙酸乙酯、油脂、葡萄糖、蛋白质均可以发生水解反应 | |
| C. | 化合物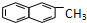 是苯的同系物 是苯的同系物 | |
| D. | 地沟油和矿物油可通过加足量的氢氧化钠溶液加热后的不同现象加以区别 |
17.下列说法正确的是( )
| A. | 共价化合物中不含离子键 | |
| B. | 凡是金属元素跟非金属元素化合形成离子化合物 | |
| C. | 离子化合物中的阳离子都是金属离子 | |
| D. | 溶于水可以导电的化合物一定是离子化合物 |
4.某同学做同周期元素性质递变规律实验时,设计了一套实验方案,并记录了有关实验现象(见下表,表中左右的“实验方案”与“实验现象”不一定是对应关系).
请你帮助该同学整理并完成实验报告.
(1)实验目的:研究第3周期元素性质的递变规律.
(2)实验用品:
试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液,AlCl3溶液,NaOH
溶液,酚酞溶液等.
仪器:砂纸,试管,试管夹,①酒精灯,火柴,胶头滴管,烧杯,镊子,小刀,玻璃片,②滤纸等.
(3)实验内容:
①的化学方程式Mg+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2+H2↑,
②的离子方程式S2-+Cl2=2Cl-+S↓.
(4)实验结论:第3周期,随着原子序数的递增,元素的金属性减弱,非金属性增强;.
| 实验方案 | 实验现象 |
| ①镁条除去氧化膜后,放入试管中,加入少量水,加热至沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变红色 |
| ②向新制得的Na2S溶液中滴加新制的氯水 | B.有气体产生,溶液变成浅红色 |
| ③将小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体 |
| ④将除去氧化膜的镁条投入稀盐酸中 | D.反应不十分剧烈,产生无色气体 |
| ⑤将除去氧化膜的铝条投入稀盐酸中 | E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向A1Cl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉淀 |
(1)实验目的:研究第3周期元素性质的递变规律.
(2)实验用品:
试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液,AlCl3溶液,NaOH
溶液,酚酞溶液等.
仪器:砂纸,试管,试管夹,①酒精灯,火柴,胶头滴管,烧杯,镊子,小刀,玻璃片,②滤纸等.
(3)实验内容:
| 实验方案 | ② | ④ | ⑥ |
| 实验现象(填A~F) |
②的离子方程式S2-+Cl2=2Cl-+S↓.
(4)实验结论:第3周期,随着原子序数的递增,元素的金属性减弱,非金属性增强;.