题目内容
2.(1)在标准状况下4.48L CH4和CO2混合气体的质量为6.0g,则混合气体平均摩尔质量为30 g/mol,相对于氢气的密度为15;CH4和CO2的质量比为4:11.(2)相同体积、相同物质的量浓度的AgNO3溶液,分别与相同体积的KCl、CuCl2、AlCl3溶液反应恰好完全反应,则KCl、CuCl2、AlCl3三种溶液的物质的量浓度之比为6:3:2.
(3)标准状况下,V L的某气体(摩尔质量为M g•mol-1)溶解在1L水(水的密度近似为1g•cm-3)中,假设气体完全溶解且不与水发生反应,溶液的密度为ρg•cm-3,则所得溶液的物质的量浓度c=$\frac{1000ρV}{22400+VM}$mol/L.(选择以上字母表达计算式,要求化简).
分析 (1)根据n=$\frac{V}{{V}_{m}}$计算混合气体总物质的量,根据$\overline{M}$=$\frac{{m}_{总}}{{n}_{总}}$计算平均摩尔质量,相同条件下气体的密度之比等于摩尔质量之比,根据总质量、总物质的量列方程计算各自物质的量,再根据m=nM计算二者质量之比;
(2)相同体积、相同物质的量浓度的AgNO3溶液中的AgNO3物质的量相同,则氯离子物质的量相等,假设氯离子为3mol,计算KCl、CuCl2、AlCl3的物质的量,溶液体积相等,浓度之比等于其物质的量之比;
(3)根据n=$\frac{V}{{V}_{m}}$计算气体的物质的量,根据m=nM计算气体质量,根据m=ρV计算水的质量,溶液质量=水的质量+气体质量,根据V=$\frac{m}{ρ}$计算溶液体积,再根据c=$\frac{n}{V}$计算溶液物质的量浓度.
解答 解:(1)混合气体总物质的量为$\frac{4.48L}{22.4L/mol}$=0.2mol,则平均摩尔质量为$\frac{6g}{0.2mol}$=30g/mol,
相同条件下气体的密度之比等于摩尔质量之比,则混合气体相等氢气密度为$\frac{30g/mol}{2g/mol}$=15,
设甲烷、二氧化碳物质的量分别为xmol、ymol,则:$\left\{\begin{array}{l}{x+y=0.2}\\{16x+44y=6}\end{array}\right.$,解得x=y=0.1,故CH4和CO2的质量比为0.1mol×16g/mol:0.1mol×44g/mol=4:11,
故答案为:30;15;4:11;
(2)相同体积、相同物质的量浓度的AgNO3溶液中的AgNO3物质的量相同,则氯离子物质的量相等,假设氯离子为3mol,则KCl为3mol、CuCl2为1.5mol,AlCl3为1mol,溶液体积相等,浓度之比等于其物质的量之比,故KCl、CuCl2、AlCl3三种溶液的物质的量浓度之比为3mol:1.5mol:1mol=6:3:2,
故答案为:6:3:2;
(3)气体的物质的量为$\frac{VL}{22.4L/mol}$=$\frac{V}{22.4}$mol,气体质量为$\frac{V}{22.4}$mol×Mg/mol=$\frac{VM}{22.4}$g,水的质量为1000mL×1g/mL=1000g,溶液质量=(1000+$\frac{VM}{22.4}$)g,溶液体积为$\frac{(1000+\frac{VM}{22.4})g}{1000ρg/L}$=$\frac{22400+VM}{22400ρ}$L,溶液物质的量浓度为$\frac{\frac{V}{22.4}mol}{\frac{22400+VM}{22400ρ}L}$=$\frac{1000ρV}{22400+VM}$mol/L,
故答案为:$\frac{1000ρV}{22400+VM}$.
点评 本题考查物质的量有关计算,注意对物质的量浓度定义式的理解,(3)中计算溶液体积是关键,难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | SO2、SiO2、NO2均为酸性氧化物 | B. | 稀豆浆、硅酸、氯化铁溶液均为胶体 | ||
| C. | 烧碱、冰醋酸、四氯化碳均为电解质 | D. | 汽油、水玻璃、氨水均为混合物 |
| A. | 氨气的结构式为 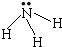 | B. | 醛基的结构简式:-COH | ||
| C. | 羟基的电子式: | D. | 甲醇的球棍模型: |
| A. | K+、Cl-、MnO4-、SO42- | B. | Na+、K+、AlO2-、NO3- | ||
| C. | Na+、NO3-、SO42-、HCO3- | D. | Na+、Cu2+、NO3-、CO32- |
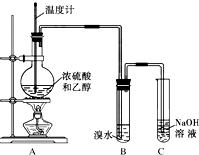 为探究乙烯的制取及乙烯和溴水反应的有关问题,甲、乙、丙三同学进行了如下实验活动,请你参与他们的活动并回答相关问题.
为探究乙烯的制取及乙烯和溴水反应的有关问题,甲、乙、丙三同学进行了如下实验活动,请你参与他们的活动并回答相关问题. 如图装置,用电化学原理制备硫酸,并电解500mL 0.2mol?L-1AgNO3溶液.请回答下列问题:
如图装置,用电化学原理制备硫酸,并电解500mL 0.2mol?L-1AgNO3溶液.请回答下列问题: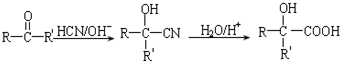
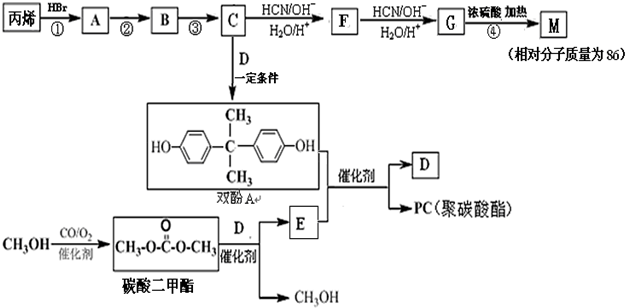
 .
. 、
、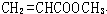 、
、 .
.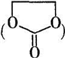 能与CH3OH发生酯交换反应生成碳酸二甲酯和另一种醇,写出该反应的化学方程式
能与CH3OH发生酯交换反应生成碳酸二甲酯和另一种醇,写出该反应的化学方程式
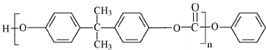 或
或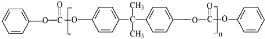 .
. 为探究乙烯与溴的加成反应,甲同学设计并进行了如下实验:先用乙醇和浓硫酸为原料制取乙烯,将生成的气体直接通入溴水中,发现溶液褪色,即证明乙烯与溴水发生了加成反应.
为探究乙烯与溴的加成反应,甲同学设计并进行了如下实验:先用乙醇和浓硫酸为原料制取乙烯,将生成的气体直接通入溴水中,发现溶液褪色,即证明乙烯与溴水发生了加成反应.