题目内容
【题目】N2(g)+3H2(g)![]() 2NH3(g)反应过程中能量变化如图所示,下列有关叙述正确
2NH3(g)反应过程中能量变化如图所示,下列有关叙述正确

A.该反应正反应的活化能小于逆反应的活化能
B.该反应的逆反应为放热反应
C.使用催化剂使该反应的反应热发生改变
D.该反应的ΔH=E2-E1
【答案】A
【解析】
由图可知,反应物的总能量大于生成物总能量,为放热反应,结合△H=正反应的活化能-逆反应的活化能分析解答。
A.N2(g)+3H2(g)![]() 2NH3(g)为放热反应,△H<0,△H=正反应的活化能-逆反应的活化能,则反应正反应的活化能小于逆反应的活化能,故A正确;
2NH3(g)为放热反应,△H<0,△H=正反应的活化能-逆反应的活化能,则反应正反应的活化能小于逆反应的活化能,故A正确;
B.N2(g)+3H2(g)![]() 2NH3(g)为放热反应,则反应的逆反应为吸热反应,故B错误;
2NH3(g)为放热反应,则反应的逆反应为吸热反应,故B错误;
C.使用催化剂,反应的反应热不变,故C错误;
D.由图可知该反应的△H=正反应的活化能-逆反应的活化能=E1-E2,故D错误;
故选A。

【题目】H2C2O4为二元弱酸,且具有还原性。
Ⅰ.20℃时,改变0.1mol·L-1H2C2O4溶液的pH,溶液中的H2C2O4、HC2O4—、C2O42—的物质的量分数δ(X)随pH的变化如图所示。

已知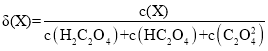
(1)Ka1(H2C2O4)=___________。
(2)0.1mol·L-1NaHC2O4溶液中离子浓度由大到小的顺序是___________。
(3)已知20℃时K(HCOOH)=1.77×10-4,向HCOONa溶液中加入少量H2C2O4,反应的离子方程式是___________。
Ⅱ.KMnO4溶液常用作氧化还原反应滴定的标准液,由于KMnO4的强氧化性,它的溶液很容易被空气中或水中的某些少量还原性物质还原,因此使用前须用H2C2O4·2H2O配制的标准溶液标定(已知:5H2C2O4+2KMnO4+3H2SO4=10CO2↑+2MnSO4+K2SO4+8H2O)。
(4)准确量取一定体积的KMnO4溶液需要使用的仪器是____________。
(5)某学生根据3次实验分别记录有关数据如表所示,该KMnO4溶液的物质的量浓度为___________mol·L-1。
实验序号 | 消耗0.1000mol·L-1的H2C2O4溶液的体积/mL | 待测KMnO4溶液的体积/mL |
1 | 29.90 | 25.00 |
2 | 30.00 | 25.00 |
3 | 30.10 | 25.00 |
(6)在上述滴定过程中,下述操作可导致被测定的KMnO4浓度偏高的是___________
a.未用标准液润洗滴定管
b.达到滴定终点,读数时俯视液面
c.盛装待测液的锥形瓶用蒸馏水洗过,未润洗
d.滴定前滴定管下端尖嘴中有气泡,滴定后气泡消失
【题目】氢气是一种清洁能源。科学家探究太阳能制氢技术,设计流程图如图:
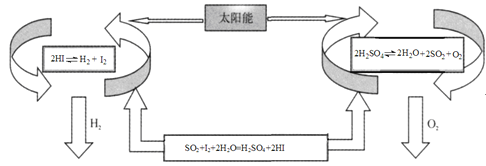
信息提示:以下反应均在150℃发生
2HI(aq)H2(g)+I2(g) △H1
SO2(g)+I2(g)+2H2O(g)=H2SO4(l)+2HI(g) △H2
2H2SO4(l)2H2O(g)+2SO2(g)+O2(g) △H3
2H2O(g)=2H2(g)+O2(g) △H4
请回答下列问题:
(1)△H4与△H1、△H2、△H3之间的关系是:△H4= ______ 。
(2)该制氢气技术的优点是 ______ ,若反应SO2(g)+I2(g)+2H2O(g)=H2SO4(l)+2HI(g)在150℃下能自发进行,则△H ______ 0(填“>”,“<”或“=”)。
(3)在某温度下,H2SO4在不同催化剂条件下分解产生氧气的量随时间变化如图所示,则下列说法正确的是 ______。
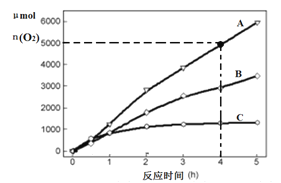
A H2SO4分解反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B 若在恒容绝热的密闭容器中发生反应,当K值不变时,说明该反应已经达到平衡
C 0~4小时在A催化剂作用下,H2SO4分解的平均速率v(O2)=1250molh-1
D 不同催化剂的催化效果不同,是因为活化分子百分数不相同
(4)对于反应:2HI(g)H2(g)+I2(g),在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
①根据上述实验结果,该反应的平衡常数 K的计算式为: ______ 。
②上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为 ______ (以K和k正表示)。若k正=0.0027min-1,在t=40min时,v正= ______ min-1。
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为 ______ (填字母)。




