题目内容
【题目】NH3和HNO3是重要的工业产品,下图为合成氨以及氨氧化制硝酸的流程。
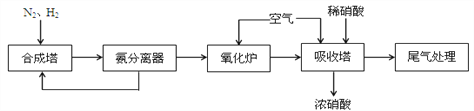
(1)合成塔中发生反应的化学方程式是_______________________________
从氨分离器中又回到合成塔中的物质是_________________。
(2)氧化炉中发生反应的化学方程式是_________________________________________
(3)尾气中的少量NO、NO2可以用NH3来处理,在催化剂作用下生成无污染的气体,写出NO2和 NH3反应的化学方程式__________________________________________________
当有5.6L NO2被还原时,转移电子的物质的量为 ________________mol.
(4)氧化炉中出来的气体,先降温再进入吸收塔,吸收塔中通入空气的作用是_________________.若进入吸收塔的气体的体积分数为NO210.0%,NO 1.32%,其余为N2、水蒸气等.当进入吸收塔中气体为10m3时,最少需要空气的体积为_____________m3。
【答案】 N2+3H2 ![]() 2NH3 N2和H2 4NH3+5O2
2NH3 N2和H2 4NH3+5O2![]() 4NO+6H2O 8NH3+6NO2
4NO+6H2O 8NH3+6NO2 ![]() 7N2+12H2O 1 mol 使NO、NO2完全转化为HNO 3 1.66
7N2+12H2O 1 mol 使NO、NO2完全转化为HNO 3 1.66
【解析】(1)合成塔中发生的反应是氮气和氢气的化合反应,反应的化学方程式是N2+3H2 ![]() 2NH3;由于是可逆反应,因此为了提高原料的利用率,从氨分离器中又回到合成塔中的物质是N2和H2;(2)氧化炉中反生的反应是氨气的催化氧化,则反应的化学方程式是4NH3+5O2
2NH3;由于是可逆反应,因此为了提高原料的利用率,从氨分离器中又回到合成塔中的物质是N2和H2;(2)氧化炉中反生的反应是氨气的催化氧化,则反应的化学方程式是4NH3+5O2![]() 4NO+6H2O;(3)尾气中的少量NO、NO2可以用NH3来处理,在催化剂作用下生成无污染的气体,因此生成的气体是氮气和二氧化碳,则NO2和NH3反应的化学方程式为8NH3+6NO2
4NO+6H2O;(3)尾气中的少量NO、NO2可以用NH3来处理,在催化剂作用下生成无污染的气体,因此生成的气体是氮气和二氧化碳,则NO2和NH3反应的化学方程式为8NH3+6NO2 ![]() 7N2+12H2O;反应中氮元素的化合价从+4价降低到0价,因此当有5.6LNO2被还原时,即0.25molNO2被还原,则转移电子的物质的量为1mol;(4)为提高原料的利用率,则氧化炉中出来的气体,先降温再进入吸收塔,因此吸收塔中通入空气的作用是使NO2和NO全部转化为HNO3;二氧化氮和一氧化氮的体积分别是1 m3和0.132 m3,根据电子得失守恒可知需要氧气的体积是
7N2+12H2O;反应中氮元素的化合价从+4价降低到0价,因此当有5.6LNO2被还原时,即0.25molNO2被还原,则转移电子的物质的量为1mol;(4)为提高原料的利用率,则氧化炉中出来的气体,先降温再进入吸收塔,因此吸收塔中通入空气的作用是使NO2和NO全部转化为HNO3;二氧化氮和一氧化氮的体积分别是1 m3和0.132 m3,根据电子得失守恒可知需要氧气的体积是![]() ,所以需要空气的体积是
,所以需要空气的体积是![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】甲酸甲酯水解反应方程式为:HCOOCH3(l)+H2O(l)HCOOH(l)+CH3OH(l)△H>0某温度下,V L混合体系中各组分的起始量如下表,HCOOCH3转化率随反应时间t的变化如图(假设混合体系体积不变).下列说法正确的是( )
组分 | 物质的量/mol |
HCOOCH3 | 1.00 |
H2O | 1.99 |
HCOOH | 0.01 |
CH3OH | 0.52 |
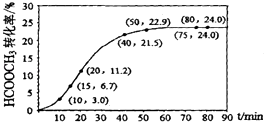
A.温度升髙,该反应的平衡常数减小
B.010min,HCOOCH3的平均反应速率v=0.003molL﹣1min﹣1
C.HCOOCH3水解平均反应速率先是增大,后减小,最后保持不变
D.该条件下达到平衡状态,反应物转化率相等