��Ŀ����
����Ŀ�����ͷ������������������а�������Ҫ�Ľ�ɫ�����ݴ��ͷӵĸ�������ʻش��������⡣
��1�������������ڴ��������
��2��˾���ƺ�ݳ�ʱ�ɼ�������������壬�����õĻ�ѧ��Ӧ���£�
2CrO3(��ɫ)��3C2H5OH��3H2SO4=Cr2(SO4)3(��ɫ)��3CH3CHO��6H2O
����������ɷ��� �� ������Ӧ�е��������� �� ��ԭ������
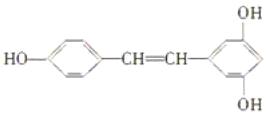
��3��300����ǰ��������ѧ�Ҳ����������������ûʳ�������ɫ��Ӧ�����ɴ˷���������īˮ��ûʳ����Ľṹ��ʽΪ��  ��ûʳ��������īˮ��Ҫ�����ˣ� ������������(�����)��
��ûʳ��������īˮ��Ҫ�����ˣ� ������������(�����)��
A.��
B.��
C.��֬
D.����
���𰸡�
��1���٢ڢۢܢݢ�
��2��C2H5OH��CrO3��C2H5OH
��3��B
��������(1)�ǻ��������������ϵ�̼ԭ�������Ļ�����Ϊ�����ǻ�ֱ�����ڱ����ϵĻ�����Ϊ�ӣ���ˣ������ڷӣ��������Ϊ����(2)2CrO3(��ɫ)��3C2H5OH��3H2SO4=Cr2(SO4)3(��ɫ)��3CH3CHO��6H2O����Ӧ��CrO3��C2H5OH����ΪCH3CHO�����Ա�������ΪC2H5OH��������ΪCrO3 �� ��ԭ��ΪC2H5OH��(3)��ûʳ��������īˮ��Ҫ���÷ӵ����ʡ�

����Ŀ��2014��7��31���й����������ӱ�ʡ��չ������������ר�������ж���ǿ�������ϡ�������ij������������Ҫ�ɷ�ΪSiO2��MgO��Al2O3��Fe2O3�ȳɷ֣����շ����еĽ���Ԫ�صĹ���������ͼ��ʾ�� 
��֪�������£����Ͱ�ˮ��pHԼΪ11���������ӳ�������pH���������ʾ��
���� | ������������ʽ��ȫ����ʱ����pH | �������������ȫ�ܽ�ʱ����pH |
Fe3+ | 3.2 | |
A13+ | 5.3 | 11.9 |
Mg2+ | 12.3 |
��1���Լ���Ϊ �� �Լ���Ϊ��
A��AgNO3 B��NaOH C��NH3H2O D��H2SO4
��2������C�Ļ�ѧʽ�� �� ��ҺF�н���Ԫ�صĴ�����ʽΪ��
��3��д������A���Լ��ڷ�Ӧ�Ļ�ѧ����ʽ����F��ͨ�����CO2�����������ӷ���ʽΪ��
��4�������Լ��ڣ�ʵ����ҺD����ҺF��ת�����������Һ��pHΪ ��
A.6
B.10
C.12
D.13
��5��25��ʱ������4������pH������ҺF��c��Mg2+��=5.6��10��10mol/L����������þ��Ksp=��
��6�����һ����Ӧ���漰�������Σ�������ʽ�ε���Һ�и�����Ũ���ɴ�С��˳��Ϊ ��