题目内容
10.酱油是厨房里的常见物质,下面关于补铁酱油对食品的用途的说法中正确的是( )| A. | 着色剂 | B. | 防腐剂 | C. | 营养强化剂 | D. | 增味剂 |
分析 补铁酱油在酱油中加入一种新型铁强化剂NaFeEDTA(乙二胺四乙酸铁钠),使普通酱油在添加了这种铁强化剂之后具有补充铁元素的功效,酱油为红褐色液体,有香味和咸味,据此解题.
解答 解:A.酱油的颜色是红褐色,可做着色剂,故A正确;
B.酱油无防腐作用,不能做防腐剂,故B错误;
C.缺铁会产生缺铁性贫血,常在酱油中加铁补充铁元素,补铁酱油是营养强化剂,故C正确;
D.酱油有香味和咸味,可做增味剂,故D正确.
故选ACD.
点评 本题考查了常见食品添加剂与类别的用途,学习中注意相关基础知识的积累,题目较简单.

练习册系列答案
 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案
相关题目
20.苹果酸的结构简式为 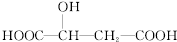 ,下列说法正确的是( )
,下列说法正确的是( )
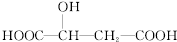 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 1mol苹果酸可与3 mol NaOH发生中和反应 | |
| B. | 1mol苹果酸与足量金属Na反应生成1mol H2 | |
| C. | 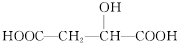 与苹果酸互为同分异构体 与苹果酸互为同分异构体 | |
| D. | 苹果酸中能发生酯化反应的官能团有2种 |
1.有一无色透明溶液,欲确定是否含有下列离子:K+、Mg2+、Al3+、Fe2+、Ba2+、NO3-、SO42-、Cl-、I-、
HCO3-,取该溶液进行如下实验,下列说法中正确的是( )
HCO3-,取该溶液进行如下实验,下列说法中正确的是( )
| 实验步骤 | 实验现象 |
| ①取少量该溶液,加几滴石蕊溶液 | 溶液变红色 |
| ②取少量该溶液,加入铜片和浓硫酸,加热 | 有无色气体产生,遇空气可以变成红棕色 |
| ③取少量该溶液,加入BaCl2溶液 | 有白色沉淀生成 |
| ④取③中的上层清液,加入AgNO3溶液 | 有稳定的白色沉淀生成,且不溶于稀硝酸 |
| ⑤取少量该溶液,加入NaOH溶液 | 有白色沉淀生成,当NaOH过量时,沉淀部分溶解 |
| A. | 溶液中一定存在的离子是SO42-、Mg2+、Al3+、Cl- | |
| B. | 溶液中一定存在的离子是NO3-、SO42-、Mg2+、Al3+ | |
| C. | 溶液中肯定不存在的离子是Fe2+、HCO3-、I-、SO42- | |
| D. | 溶液中肯定不存在的离子是Fe2+、HCO3-、Mg2+、I-、Ba2+ |
18.下列的实验事实和解释或结论都正确的是( )
| 选项 | 实验事实 | 解释或结论 |
| A | 2N2O5(g)?4NO2(g)+O2(g)△H>0 在室温下能自发进行 | 这是一个熵增的反应 |
| B | 向0.1mol•L-1的氨水中通入少量氨气,溶液的pH减小 | 电离平衡向逆方向移动,溶液中的c(OH-) 减小 |
| C | 锌与稀硫酸反应过程中,开始反应后速率逐渐增大 | 该反应是放热反应 |
| D | 已建立平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动 | 反应物的浓度一定降低 |
| A. | A | B. | B | C. | C | D. | D |
5.下列有关材料的说法正确的是( )
| A. | 金刚石因其硬度大和熔点高,所以人们目前还不能进行人工合成 | |
| B. | 无机非金属材料、金属材料和高分子材料都是我们生活和生产中不可缺少的材料,但高分子材料的共同特点是熔点低、硬度小,因此不耐高温 | |
| C. | 钛合金是新兴的形状记忆合金,将它置于人的大脑可以增强记忆功能 | |
| D. | 金属腐蚀会带来严重的危害和损失,但也可被用来进行材料加工 |
2.下列离子方程式中正确的是( )
| A. | Cu(OH)2与盐酸反应:H++OH-=H2O | |
| B. | 氨气通入醋酸溶液中:NH3+CH3COOH=CH3COO-+NH4+ | |
| C. | MgSO4溶液与Ba(OH)2溶液反应:SO42-+Ba2+=BaSO4↓ | |
| D. | CaCO3与稀盐酸反应:CO32-+2H+=H2CO3 |
3.工业上回收利用某合金废料(主要含Fe、Cu、Co、Li等,已知Co、Fe都是中等活泼金属)的工艺流程如下:
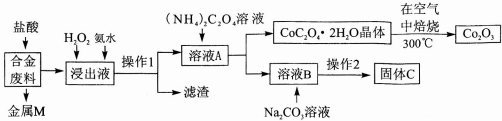
(1)金属M为Cu,操作1为过滤.
(2)加入H2O2的作用是(用离子方程式表示)2Fe2++H2O2+2H+=2Fe3++2H2O,加入氨水的作用是调节溶液的pH使Fe3+转化为Fe(OH)3沉淀.
(3)充分焙烧的化学方程式为4CoC2O4?2H2O+3O2$\frac{\underline{\;焙烧\;}}{\;}$2Co2O3+8 H2O+8CO2.
(4)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系见下表.操作2中,蒸发浓缩后必须趁热过滤,其原因是减少Li2CO3的溶解损失,90℃时Ksp(Li2CO3)的值为4.0×10-3.
(5)用惰性电极电解熔融Li2CO3制取锂,阳极生成两种气体,则阳极的电极反应式为2CO32--4e-=O2↑+2CO2↑.

(1)金属M为Cu,操作1为过滤.
(2)加入H2O2的作用是(用离子方程式表示)2Fe2++H2O2+2H+=2Fe3++2H2O,加入氨水的作用是调节溶液的pH使Fe3+转化为Fe(OH)3沉淀.
(3)充分焙烧的化学方程式为4CoC2O4?2H2O+3O2$\frac{\underline{\;焙烧\;}}{\;}$2Co2O3+8 H2O+8CO2.
(4)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系见下表.操作2中,蒸发浓缩后必须趁热过滤,其原因是减少Li2CO3的溶解损失,90℃时Ksp(Li2CO3)的值为4.0×10-3.
| 温度/℃ | 10 | 30 | 60 | 90 |
| 浓度/mol•L-1 | 0.21 | 0.17 | 0.14 | 0.10 |
4. NaCl和NH4Cl共同存在时的溶解度曲线如图所示,利用NaCl和NH4Cl溶解度的差异,向混合溶液中通入某种气体,同时加入磨细的食盐,有利于析出NH4Cl.以下说法中正确的是( )
NaCl和NH4Cl共同存在时的溶解度曲线如图所示,利用NaCl和NH4Cl溶解度的差异,向混合溶液中通入某种气体,同时加入磨细的食盐,有利于析出NH4Cl.以下说法中正确的是( )
 NaCl和NH4Cl共同存在时的溶解度曲线如图所示,利用NaCl和NH4Cl溶解度的差异,向混合溶液中通入某种气体,同时加入磨细的食盐,有利于析出NH4Cl.以下说法中正确的是( )
NaCl和NH4Cl共同存在时的溶解度曲线如图所示,利用NaCl和NH4Cl溶解度的差异,向混合溶液中通入某种气体,同时加入磨细的食盐,有利于析出NH4Cl.以下说法中正确的是( )| A. | 0℃时,饱和的NaCl和NH4Cl混合溶液中,NaCl的物质的量浓度是NH4Cl的2倍 | |
| B. | 30℃时,饱和的NaCl和NH4Cl混合溶液中,两者的物质的量浓度相等 | |
| C. | 通入的气体可能是NH3,控制在0~10℃结晶出NH4Cl | |
| D. | 通入的气体可能是CO2,控制在30~40℃结晶出NH4Cl |