题目内容
【题目】X、Y、Z、W、R为五种短周期元素,其原子半径和最外层电子数之间的关系如下图所示。下列说法错误的是
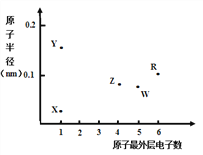
A. 简单离子半径:Y < W
B. 最高价氧化物对应水化物的酸性:Z < W
C. R为氧元素
D. X与Z可以形成正四面体结构的分子
【答案】C
【解析】X、Y、Z、W、R为五种短周期元素,X、Y最外层只有一个电子,为第IA族元素;Z最外层有4个电子,位于第IVA族,W原子最外层有5个电子,位于第VA族,R最外层有6个电子,位于第VIA族;Y原子半径最大,为Na元素,X原子半径最小,为H元素;Z原子和W原子半径接近、W原子半径大于Z而最外层电子数大于Z,所以Z是C、W是N、R为S元素;A.Y离子为Na+,有两个电子层,而W离子为N3-,也有2个电子层,而当电子层数相同时,核电荷数越大,半径越小,故简单离子半径:Y<W,故A正确;B.元素的非金属性越强,其最高价含氧酸的酸性越强,由于Z为C元素,而W为N元素,非金属性W更强,故最高价氧化物对应水化物的酸性:Z<W,故B正确;C.由于R处于第VIA族,且半径大于Z和E,故R为硫元素,故C错误;D.X、Z可以形成CH4,而甲烷是正四面体结构,故D正确;故选C。

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案
相关题目