题目内容
2.部分弱酸的电离平衡常数如下表:| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数 (25℃) | Ka=1.77×10-4 | Ka=4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
| A. | 2CN-+H2O+CO2=2HCN+CO32- | |
| B. | 中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者大于后者 | |
| C. | 物质的量浓度相等的HCOONa和KCN溶液中,c(Na+)-c(HCOO-)<c(K+)-c(CN-) | |
| D. | c(NH4+) 相等的HCOONH4溶液、NH4CN溶液、NH4HCO3溶液中,c(NH4HCO3)>c(NH4CN)>c(HCOONH4) |
分析 A.酸的电离平衡常数越大,酸的酸性越强,根据强酸制取弱酸解答;
B.等pH的HCOOH和HCN,酸的电离平衡常数越大,该酸的浓度越小,等体积等pH的不同酸消耗NaOH的物质的量与酸的物质的量成正比;
C.酸的电离平衡常数越大,则其酸根离子水解程度越小,酸的电离平衡常数HCOOH>HCN,则酸根离子水解程度HCOO-<CN-,所以溶液中阴离子浓度c(HCOO-)>c(CN-);
D.酸的电离平衡常数越大,其酸根离子水解程度越小,促进铵根离子水解程度越小,则相同浓度的这几种盐溶液中铵根离子浓度越大.
解答 解:酸的电离平衡常数HCOOH>H2CO3>HCN>HCO3-,则酸性:HCOOH>H2CO3>HCN>HCO3-,酸根离子水解程度CO32->CN->HCO3->HCOO-,
A.酸的电离平衡常数越大,酸的酸性越强,强酸能够制取弱酸,所以二者反应生成HCN和HCO3-,正确的离子方程式为:CN-+H2O+CO2═HCN+HCO3-,故A错误;
B.等pH、等体积的HCOOH和HCN,n(HCN)>n(HCOOH),中和酸需要碱的物质的量与酸的物质的量、酸的元数成正比,所以中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者,故B错误;
C.酸的电离平衡常数HCOOH>HCN,则酸根离子水解程度HCOO-<CN-,所以溶液中阴离子浓度c(HCOO-)>c(CN-),物质的量浓度相等的HCOONa和KCN,则c(Na+)=c(K+),所以c(Na+)-c(HCOO-)<c(K+)-c(CN-),故C正确;
D.酸的电离平衡常数HCOOH>H2CO3>HCN>HCO3-,则酸根离子水解程度CO32->CN->HCO3->HCOO-,促进铵根离子水解程度大小顺序是CO32->CN->HCO3->HCOO-,则相同浓度的这几种盐溶液中c(NH4+)大小顺序是c(NH4CN)<c(NH4HCO3)<c(HCOONH4),所以c(NH4+)相等的HCOONH4溶液、NH4CN溶液、NH4HCO3溶液中c(NH4CN)>c(NH4HCO3)>c(HCOONH4),故D错误;
故选C.
点评 本题考查了离子浓度大小比较,题目难度中等,明确酸的电离平衡常数与酸的强弱、酸根离子水解程度大小之间的关系是解本题关键,再结合物料守恒、物质的性质等知识点来分析解答,D为易错点,注意采用逆向思维的方法确定盐溶液浓度.

| A. | 1:2 | B. | 2:1 | C. | 1:1 | D. | 2:3 |
| A. | 0.5mol/L 的HCl | B. | 0.5mol/L 的CH3COOH | ||
| C. | 蒸馏水 | D. | 0.5mol/L 的氨水 |
| A. | 硫酸铝与氨水反应:Al3++3OH-=Al(OH)3↓ | |
| B. | 醋酸溶解鸡蛋壳:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| C. | 在NaHCO3溶液中滴入少量澄清石灰水:Ca2++OH-+HCO3-=CaCO3↓+H2O | |
| D. | 在NaHSO4溶液中滴入Ba(OH)2溶液至溶液呈中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
| 化合价 | 甲 | 乙 | 丙 |
| 元素种类 | A、B | A、C | C、D |
(1)乙的电子式为
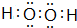 ,丙中阴离子与阳离子的个数比为1:2
,丙中阴离子与阳离子的个数比为1:2(2)已知甲是同系列中最简单的化合物,且在标准状况下,5.6L的甲完全燃烧放出的热量为325kJ,试写出甲的燃烧热的热化学方程式C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(l)△H=-1300kJ/mol
(3)研究表明,乙是一种二元弱酸,请写出乙在水中的电离方程式H2O2?H++HO2-,HO2-?H++O2-
(4)A、B、C、D所对应元素的原子半径大小顺序为Na>C>O>H (用元素符号表示).
| A. | 摩尔是一个物理量 | B. | 物质的量就是物质的粒子数目 | ||
| C. | 硫酸的摩尔质量是98 g | D. | 18 g水中含有1 molH2O |
 Al(OH)3(胶体)+3H+.
Al(OH)3(胶体)+3H+.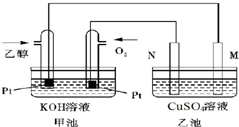 如图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题:
如图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题: