题目内容
11.A、B、C、D为原子序数依次增大的四种短周期元素,A、D同主族,B、C同周期.它们中的两种元素可形成多种原子个数比为1:1的化合物,甲、乙、丙为其中的三种,它们的元素组成如下表:| 化合价 | 甲 | 乙 | 丙 |
| 元素种类 | A、B | A、C | C、D |
(1)乙的电子式为
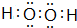 ,丙中阴离子与阳离子的个数比为1:2
,丙中阴离子与阳离子的个数比为1:2(2)已知甲是同系列中最简单的化合物,且在标准状况下,5.6L的甲完全燃烧放出的热量为325kJ,试写出甲的燃烧热的热化学方程式C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(l)△H=-1300kJ/mol
(3)研究表明,乙是一种二元弱酸,请写出乙在水中的电离方程式H2O2?H++HO2-,HO2-?H++O2-
(4)A、B、C、D所对应元素的原子半径大小顺序为Na>C>O>H (用元素符号表示).
分析 A、B、C、D是四种短周期元素,它们的原子序数依次增大A、B形成原子个数1:1的化合物甲为气体,密度略小于空气,A、C形成原子个数1:1的化合物乙为液态,B、C同周期,甲应为C2H2,乙应为H2O2,则A为氢元素、B为碳元素、C为O元素;A、D元素同主族,D的原子序数大于氧,则D为Na;C、D形成原子个数1:1的化合物丙为Na2O2,据此解答.
解答 解:A、B、C、D是四种短周期元素,它们的原子序数依次增大A、B形成原子个数1:1的化合物甲为气体,密度略小于空气,A、C形成原子个数1:1的化合物乙为液态,B、C同周期,甲应为C2H2,乙应为H2O2,则A为氢元素、B为碳元素、C为O元素;A、D元素同主族,D的原子序数大于氧,则D为Na;C、D形成原子个数1:1的化合物丙为Na2O2.
(1)乙为H2O2,电子式为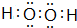 ,丙为Na2O2,由钠离子与过氧根离子构成,阴离子与阳离子的个数比为1:2,
,丙为Na2O2,由钠离子与过氧根离子构成,阴离子与阳离子的个数比为1:2,
故答案为: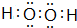 ;1:2;
;1:2;
(2)标准状况下5.6LC2H2完全燃烧生成稳定氧化物时放出的热量为325kJ,1molC2H2完全燃烧放出的热量=325kJ×$\frac{1mol×22.4L/mol}{5.6L}$=1300kJ,则C2H2燃烧热的热化学方程式为:C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(l)△H=-1300kJ/mol,
故答案为:C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(l)△H=-1300kJ/mol;
(3)研究表明H2O2物质具有弱酸性,则H2O2物质在水中的电离方程式为:H2O2?H++HO2-,HO2-?H++O2-,
故答案为:H2O2?H++HO2-,HO2-?H++O2-;
(4)同周期自左而右原子半径减小、同主族自上而下原子半径增大,所有元素中H原子半径最小,故原子半径:Na>C>O>H,
故答案为:Na>C>O>H.
点评 本题考查元素化合物推断,需要学生熟练掌握常见原子个数为1:1物质,注意燃烧热热化学方程式的书写,难度中等.

| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数 (25℃) | Ka=1.77×10-4 | Ka=4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
| A. | 2CN-+H2O+CO2=2HCN+CO32- | |
| B. | 中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者大于后者 | |
| C. | 物质的量浓度相等的HCOONa和KCN溶液中,c(Na+)-c(HCOO-)<c(K+)-c(CN-) | |
| D. | c(NH4+) 相等的HCOONH4溶液、NH4CN溶液、NH4HCO3溶液中,c(NH4HCO3)>c(NH4CN)>c(HCOONH4) |
| A. | 1 L H2SO4溶液中含98g H2SO4 | B. | 0.1 L含24.5g H2SO4的溶液 | ||
| C. | 0.5 L水中溶有49g H2SO4 | D. | 98g H2SO4溶于水配成2 L溶液 |
| A. | 维生素E 属于脂溶性维生素 | B. | 植物油的熔点比动物油高 | ||
| C. | 纤维素在人体内可以转化为脂肪 | D. | 脂肪是提供人体能量的主要的物质 |
| A. | 明矾-净化水 | B. | 漂白粉-漂白织物 | C. | 食醋-除水垢 | D. | 纯碱-去油污 |
| A. | 选用480 mL容量瓶,称取12.0g硫酸铜,配成480mL溶液 | |
| B. | 选用250 mL容量瓶,称取12.5g胆矾,配成500mL溶液 | |
| C. | 选用500 mL容量瓶,称取12.5g胆矾,加入500mL水 | |
| D. | 选用500 mL容量瓶,称取12.5g胆矾,配成500mL溶液 |
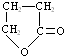 ,化合物C的结构简式是HOCH2CH=CHCOONa.
,化合物C的结构简式是HOCH2CH=CHCOONa.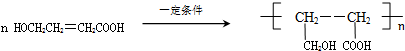 .
. ,E元素的电子排布式为1s22s22p63s23p63d5s4s1.
,E元素的电子排布式为1s22s22p63s23p63d5s4s1.