题目内容
10.在100ml 下列溶液中,分别加入0.05molNaOH 固体,溶液的导电性变化不大的是( )| A. | 0.5mol/L 的HCl | B. | 0.5mol/L 的CH3COOH | ||
| C. | 蒸馏水 | D. | 0.5mol/L 的氨水 |
分析 溶液导电性与离子浓度成正比、与电荷成正比,在100ml下列溶液中,分别加入0.05molNaOH 固体,溶液的导电性变化不大,说明溶液中离子浓度变化不大,据此分析解答.
解答 解:A.盐酸是强酸,向溶液中加入氢氧化钠后,氢氧化钠和盐酸反应生成氯化钠和水,氯化钠是强电解质,所以离子浓度变化不大,所以溶液导电能力变化不大,故A选;
B.醋酸是弱电解质,氢氧化钠和醋酸反应生成醋酸钠,溶液中的溶质由弱电解质变成强电解质,离子浓度增大,溶液的导电能力增大,故B不选;
C.水是弱电解质且水的电离程度很小,所以水中自由移动离子浓度很小,向水中加入氢氧化钠固体,氢氧化钠是强电解质,导致溶液中离子浓度增大,所以导电能力变化较大,故C不选;
D.一水合氨是弱电解质,氢氧化钠是强电解质,向氨水中加入氢氧化钠固体后,溶液中离子浓度增大,所以导电能力增大,故D不选.
故选A.
点评 本题考查溶液导电性强弱判断,明确溶液导电性强弱影响因素是解本题关键,注意溶液导电性强弱与电解质强弱无关,强电解质溶液导电性不一定比弱电解质溶液导电性强,为易错题.

练习册系列答案
相关题目
20.物质的量浓度相同的NaCl MgCl2 AlCl3三种溶液,当溶液的体积比为1:1:1时,三种溶液中Cl-的物质的量之比为( )
| A. | 1:1:1 | B. | 1:2:3 | C. | 3:2:1 | D. | 3:4:3 |
5.对于反应3S+6KOH=K2SO3+2K2S+3H2O的分析正确的是( )
| A. | S做还原剂 | B. | KOH做氧化剂 | C. | K2SO3做氧化剂 | D. | K2S做还原剂 |
15.下列各组的离子中,能在溶液中大量共存的是( )
| A. | K+、H+、SO42-、OH- | B. | Na+、H+、Cl-、CO32- | ||
| C. | Na+、Ca2+、CO32-、NO3- | D. | K+、Cu2+、Cl-、SO42- |
2.部分弱酸的电离平衡常数如下表:
下列选项正确的是( )
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数 (25℃) | Ka=1.77×10-4 | Ka=4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
| A. | 2CN-+H2O+CO2=2HCN+CO32- | |
| B. | 中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者大于后者 | |
| C. | 物质的量浓度相等的HCOONa和KCN溶液中,c(Na+)-c(HCOO-)<c(K+)-c(CN-) | |
| D. | c(NH4+) 相等的HCOONH4溶液、NH4CN溶液、NH4HCO3溶液中,c(NH4HCO3)>c(NH4CN)>c(HCOONH4) |
19.下列溶液中,物质的量浓度最大的是( )
| A. | 1 L H2SO4溶液中含98g H2SO4 | B. | 0.1 L含24.5g H2SO4的溶液 | ||
| C. | 0.5 L水中溶有49g H2SO4 | D. | 98g H2SO4溶于水配成2 L溶液 |
20.化学与生活密切相关.下列应用中利用了物质氧化性的是( )
| A. | 明矾-净化水 | B. | 漂白粉-漂白织物 | C. | 食醋-除水垢 | D. | 纯碱-去油污 |
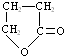 ,化合物C的结构简式是HOCH2CH=CHCOONa.
,化合物C的结构简式是HOCH2CH=CHCOONa.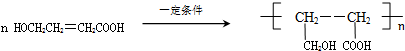 .
.