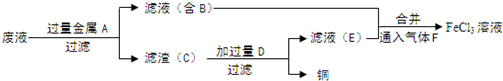
题目内容
17. X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子,G不是稀有气体元素.请回答下列问题:
X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子,G不是稀有气体元素.请回答下列问题:(1)Y在元素周期表中的位置为第二周期ⅥA族.
(2)上述元素的最高价氧化物对应的水化物酸性最强的是HClO4(写化学式),非金属气态氢化物还原性最强的是H2S(写化学式).
(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有O3、ClO2(写出其中两种物质的化学式).
(4)ZX的电子式为
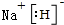 ;ZX与水反应放出气体的化学方程式为2NaH+H2O=2NaOH+H2↑.
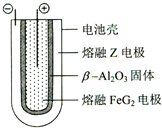
;ZX与水反应放出气体的化学方程式为2NaH+H2O=2NaOH+H2↑.(5)熔融状态下,Z的单质和FeG2能组成可充电电池(装置示意图如图),反应原理为:2Z+FeG2
 Fe+2ZG,放电时,电池的正极反应式为Fe2++2e-=Fe,该电池的电解质为β-Al2O3.
Fe+2ZG,放电时,电池的正极反应式为Fe2++2e-=Fe,该电池的电解质为β-Al2O3.
分析 X、Y、Z、M、G五种元素分属三个短周期,原子序数依次增大.Y、M同主族,可形成MY2、MY3两种分子,则M为S元素、Y为氧元素;X、Z同主族,可形成离子化合物ZX,则Z为Na、X为H元素;G原子序数大于S原子序数,且G不是稀有气体元素,则G为Cl元素.
(1)主族元素周期数=电子层数、主族族序数=最外层电子数;
(2)非金属性越强,最高价含氧酸的酸性越强,氢化物还原性越弱;
(3)Y的单质O3、G的单质Cl2、二者形成的ClO2可作消毒剂;
(4)ZX为NaH,属于离子化合物,由钠离子与氢负离子构成,Na与水反应是氢氧化钠与氢气;
(5)放电时,为原电池,原电池的正极发生还原反应,Fe2+在正极放电生成Fe,正极反应式为,Fe2++2e-=Fe,由电池结构可知,该电池的电解质为β-Al2O3.
解答 解:X、Y、Z、M、G五种元素分属三个短周期,原子序数依次增大.Y、M同主族,可形成MY2、MY3两种分子,则M为S元素、Y为氧元素;X、Z同主族,可形成离子化合物ZX,则Z为Na、X为H元素;G原子序数大于S原子序数,且G不是稀有气体元素,则G为Cl元素.
(1)Y为氧元素,在元素周期表中的位置为第二周期ⅥA族,故答案为:第二周期ⅥA族;
(2)非金属性越强,最高价含氧酸的酸性越强,氢化物还原性越弱,上述元素的最高价氧化物对应的水化物酸性最强的是HClO4,非金属气态氢化物还原性最强的是H2S,故答案为:HClO4;H2S;
(3)Y的单质O3、G的单质Cl2、二者形成的ClO2可作消毒剂,故答案为:O3、ClO2;
(4)ZX为NaH,属于离子化合物,由钠离子与氢负离子构成,电子式为  ,Na与水反应是氢氧化钠与氢气,反应化学方程式为为:NaH+H2O=NaOH+H2↑,
,Na与水反应是氢氧化钠与氢气,反应化学方程式为为:NaH+H2O=NaOH+H2↑,
故答案为: ;NaH+H2O=NaOH+H2↑;
;NaH+H2O=NaOH+H2↑;
(5)熔融状态下,Na的单质和FeCl2能组成可充电电池,反应原理为:2Na+FeCl2  Fe+2NaCl. 放电时,为原电池,原电池的正极发生还原反应,Fe2+在正极放电生成Fe,正极反应式为,Fe2++2e-=Fe,由电池结构可知,该电池的电解质为β-Al2O3,故答案为:Fe2++2e-=Fe;β-Al2O3.
Fe+2NaCl. 放电时,为原电池,原电池的正极发生还原反应,Fe2+在正极放电生成Fe,正极反应式为,Fe2++2e-=Fe,由电池结构可知,该电池的电解质为β-Al2O3,故答案为:Fe2++2e-=Fe;β-Al2O3.
点评 本题考查结构性质位置关系应用,涉及电子式、元素周期律、原电池、电解池断等,推断元素是解题关键,注意对基础知识的理解掌握,难度中等.

 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案| A. | 氢氧化钡溶液与硫酸反应:Ba2++2OH-+SO42-+2H+═BaSO4↓+2H2O | |
| B. | 氧化铜和稀硫酸反应:CuO+2H+═Cu2++H2O | |
| C. | 碳酸氢钠溶液和稀硫酸混合:HCO3-+H+═H2O+CO2↑ | |
| D. | 金属钠与水反应:Na+2H2O═Na++2OH-+H2↑ |
| A. | 汽油、柴油和植物油都是碳氢化合物 | |
| B. | 乙醇可以被氧化为乙酸,二者均能发生取代、氧化反应 | |
| C. | 甲烷、乙烯和苯在工业上都可通过石油分馏或裂化得到 | |
| D. | 糖类、蛋白质、脂肪都是重要的营养物质,它们都属于高分子化合物 |
| A. | 甲烷的标准燃烧热为-890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 | |
| B. | Na2CO3溶液呈碱性:CO32-+2H2O?H2CO3+2OH- | |
| C. | 氯化镁溶液与氨水反应:Mg2++2NH3•H2O═2NH4++Mg(OH)2↓ | |
| D. | 氯气溶于水制备次氯酸:Cl2+H2O═2H++Cl-++ClO- |
| A. | 化学实验室不必备有灭火器等防火器材 | |
| B. | 稀释浓硫酸时要把浓硫酸慢慢注入水中且不断搅拌 | |
| C. | 化学实验室空间较小,易燃易爆物跟其他物质可混存 | |
| D. | 一切能产生有毒气体的实验均不能在实验室中进行 |
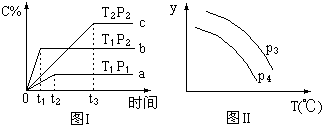 在某容积一定的密闭容器中,有下列的可逆反应:(g)+B(g)?xC(g)(正反应放热)有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)( )
在某容积一定的密闭容器中,有下列的可逆反应:(g)+B(g)?xC(g)(正反应放热)有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)( )| A. | P3>P4,y轴表示A的物质的量 | |
| B. | P3<P4,y轴表示B的体积分数 | |
| C. | P3<P4,y轴表示混合气体的密度 | |
| D. | P3>P4,y轴表示混合气体的平均相对分子质量 |
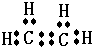 .
.