题目内容
【题目】某化学兴趣小组以黄铁矿(主要成分为FeS2)为原料进行如下实验探究。为测定黄铁矿中硫元素的质量分数,将m1g该黄铁矿样品放入如图所示装置中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品。
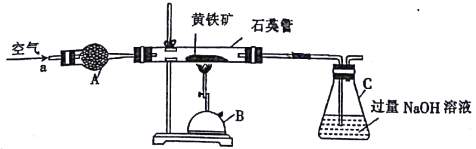
(1)仪器B的名称是________________。
(2)仪器A的作用是______________,锥形瓶C中NaOH溶液的作用是______________。
(3)反应结束后将锥形瓶C中的溶液进行如下处理:

①操作Ⅱ是洗涤、烘干、称重,其中洗涤的具体方法为______________________。
②上述流程中生成固体反应的离子方程式为__________________。
③经过分析,向m2g固体中加入过量稀盐酸时,无明显现象,则该黄铁矿中硫元素的质量分数为____(用含m1、m2的代数式表示)。
【答案】 酒精喷灯(1分) 干燥空气 吸收生成的SO2,防止其污染空气(2分) 将固体放入过滤器中,用玻璃棒引流向过滤器中加入蒸馏水至浸没沉淀,待滤液自然流下后,重复上述操作2~3次(3分) SO32-+ H2O2+Ba2+=BaSO4↓+H2O ![]()
【解析】(1)仪器B的名称是酒精喷灯。(2)空气中含有水蒸气和二氧化碳,会干扰实验,因此仪器A的作用是干燥空气。二氧化硫是大气污染物,因此锥形瓶C中NaOH溶液的作用是吸收生成的SO2,防止其污染空气。(3)①洗涤沉淀在过滤器中进行,洗涤的具体方法为将固体放入过滤器中,用玻璃棒引流向过滤器中加入蒸馏水至浸没沉淀,待滤液自然流下后,重复上述操作2~3次。②双氧水把亚硫酸钠氧化为硫酸钠,与氯化钡反应生成硫酸钡白色沉淀,反应的离子方程式为SO32-+H2O2+Ba2+=BaSO4↓+H2O。③经过分析,向m2g固体中加入过量稀盐酸时,无明显现象,说明全部是硫酸钡,则根据硫原子守恒可知该黄铁矿中硫元素的质量分数为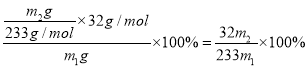 。
。


