题目内容
常温常压下NO2气体通入足量的水中,充分反应后,溶液的质量增加了54g。反应中有关物质的物理量正确的是(NA表示阿伏加德罗常数)
| | 一氧化氮 | 硝酸 | 转移的电子 |
| A. | 1mol | | 2NA |
| B. | 11.2L | 1mol | |
| C. | | 63g | 2mol |
| D. | | 1mol | NA |
D
解析试题分析:溶液的质量增加了54g,则:。
3NO2+H2O=2HNO3+NO 溶液增重△m
3mol 2mol 1mol 3×46g-30g=108g
n(NO2) n(HNO3) n(NO) 54g
故n(NO2)=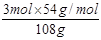 =1.5mol,n(HNO3)=
=1.5mol,n(HNO3)= =1mol,n(NO)=0.5mol,
=1mol,n(NO)=0.5mol,
A.由上述分析可知,n(NO)=0.5mol,反应中NO是还原产物,氮元素化合价由+4价降低为NO中+2价,转移电子数目为0.5mol×2×NAmol-1=NA,故A错误;B.由上述分析可知,n(HNO3)=1mol,n(NO)=0.5mol,常温常压下,气体摩尔体积不是22.4L/mol,大于22.4L/mol,故NO的体积大于0.5mol×22.4L/mol=11.2L,故B错误;C.由上述分析可知,n(HNO3)=1mol,故硝酸的质量为1mol×63g/mol=63g,n(NO)=0.5mol,故转移电子物质的量为0.5mol×2=1mol,故C错误;D.由上述分析可知,n(HNO3)=1mol,n(NO)=0.5mol,氮元素化合价由+4价降低为NO中+2价,转移电子数目为0.5mol×2×NAmol-1=NA,故D正确;故选D。
考点:本题考查常用化学计量的有关计算,难度不大,B选项注意气体摩尔体积的属于体积与
对象。

下列溶液中含Cl-浓度最大的是
| A.10mL 0.1mol·L-1的氯化铝溶液 |
| B.30mL 0.1mol·L-1的氯化钙溶液 |
| C.30mL 0.2mol·L-1的氯化钾溶液 |
| D.40mL 0.25mol·L-1的氯化钠溶液 |
下列有关甲醛的化学用语表达错误的是
| A.结构简式:HCHO | B.最简式:CH2O |
C.比例模型: | D.电子式: |
取不同质量的镁铝合金分别与25 mL同浓度的稀硝酸反应,测量合金的质量与产生气体的体积(标准状况),列表如下:
| 实验编号 | 合金质量(mg) | 气体体积(mL) |
| 1 | 144 | 112 |
| 2 | 288 | 224 |
| 3 | 864 | 560 |
若第3个实验后向反应容器内加入足量的1.0 mol/L NaOH(aq)充分反应,使固体质量不再发生变化。硝酸的浓度及至少需要NaOH(aq)的体积是
| 硝酸的浓度 | NaOH(aq)的体积 | ||
| A. | B. | C. | D. |
| 4.0 mol/L | 1.0 mol/L | 75 mL | 99 mL |
在下列条件下,两种气体的分子数一定相等的是
| A.同温度,同体积的N2和O2 | B.同质量,不同密度的N2和CO |
| C.同压强,同体积的H2和CH4? | D.同体积,同密度的CO2和N2 |
取一定量的氧化铁与氧化铜的混合物,加入稀硫酸(含0.1 mol H2SO4),恰好完全反应成盐和水,原混合物中氧元素的质量是
| A.6.4g | B.3.2g | C.1.6g | D.0.8g |
微粒有多种表示方式,下列各组不同表示方式一定代表同种微粒的是
| A.C3H6、CH2=CHCH3 | B.-OH、 |
C. 、 、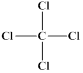 | D.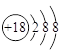 、1s22s22p63s23p6 、1s22s22p63s23p6 |
下列有关化学用语表示正确的是
A.中子数为18的硫原子: |
B.COCl2的电子式: |
C.Al3+的结构示意图: |
D.聚丙烯的结构简式: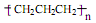 |
NA代表阿伏加德罗常数,下列说法正确的是:( )
| A.分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量为28 g |
B.已知2CO(g)+O2(g)  2CO2(g);△H=-akJ﹒mol-1将2NA个CO与NA个O2混合充分反应放出akJ的热量。 2CO2(g);△H=-akJ﹒mol-1将2NA个CO与NA个O2混合充分反应放出akJ的热量。 |
| C.用石灰乳完全吸收l mol Cl2时,转移电子的数目是NA |
| D.常温下,0.1mol/LNa2CO3溶液中,含有阴离子的总数大于0.1NA |