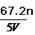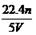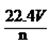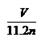题目内容
取一定量的氧化铁与氧化铜的混合物,加入稀硫酸(含0.1 mol H2SO4),恰好完全反应成盐和水,原混合物中氧元素的质量是
| A.6.4g | B.3.2g | C.1.6g | D.0.8g |
C
解析试题分析:氧化铁和氧化铜与稀硫酸反应的化学方程式为:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,CuO+H2SO4=CuSO4+H2O。由于氧化铜和氧化铁的混合物与0.1mol硫酸恰好完全反应,故联立两个化学方程式可得:
Fe2O3+CuO+4H2SO4=Fe2(SO4)3+CuSO4+4H2O
4mol 4mol
0.1mol 0.1mol
分析化学方程式可以知道硫酸根中氧元素没有发生改变,依然在硫酸根中,而氧化铜和氧化铁中的氧元素则转变为水中的氧元素,即混合物中氧元素的质量和水中氧元素的质量相等,所以水中氧元素的质量为0.1mol×18g/mol×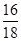 =1.6g,所以正确的答案选C。
=1.6g,所以正确的答案选C。
考点:考查氧化铁和氧化铜与稀硫酸反应的有关计算

 小学期末标准试卷系列答案
小学期末标准试卷系列答案用NA表示阿伏加德罗常数的值。下列叙述正确的是
| A.0.1 mol Fe在0.1mol CL2中充分燃烧,转移的电子数为0.3NA |
| B.标准状况下,11.2 L CCl4所含分子数约为0.5NA |
| C.常温下,pH=13的NaOH溶液中,OH-的数目为0.1NA |
| D.常温、常压下,14g CO与N2的混合气含的原子数为NA |
镁铝碱式盐对工业污水中的铬有良好吸附性。取该碱式盐0.7525g,滴加1.0mol/L盐酸,当加盐酸21.25mL时开始产生CO2气体,加入盐酸至22.50mL时恰好反应完全,向该溶液中加入过量氢氧化钠溶液,过滤,沉淀物进行干燥后重0.4350g。则该碱式盐的化学式是
| A.Al2Mg6(OH)16CO3?4H2O | B.Al4Mg12(OH)34CO3?8H2O |
| C.Al2Mg4(OH)16CO3?4H2O | D.Al3Mg6(OH)34CO3?8H2O |
常温常压下NO2气体通入足量的水中,充分反应后,溶液的质量增加了54g。反应中有关物质的物理量正确的是(NA表示阿伏加德罗常数)
| | 一氧化氮 | 硝酸 | 转移的电子 |
| A. | 1mol | | 2NA |
| B. | 11.2L | 1mol | |
| C. | | 63g | 2mol |
| D. | | 1mol | NA |
NA表示阿伏加德罗常数,有关NA的正确说法是
| A.1mol D318O+中含有的中子数为10NA |
| B.标准状况下,22.4L水中含O-H键数为2NA |
| C.某温度时1L pH=6的纯水所含OH-离子数为1.0×10-6NA |
| D.7.8 g Na2S和Na2O2的混合物中含有的阴离子数大于0.1 NA |
下列说法不正确的是
| A.等质量的乙烯和丙烯中含有的共用电子对数目相等 |
| B.等质量的 14NO和 13CO气体中含有的中子数相等 |
| C.10.6 gNa2CO3固体中含阴阳离子总数约为1.806×1023 |
| D.5.6 g铁和6.4 g铜分别与0.1 mol氯气完全反应,转移的电子数相等 |
室温下,抽去下图所示装置中的玻璃片,使两种气体充分反应。下列说法正确的是(设NA表示阿伏加德罗常数的值)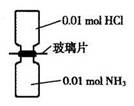
| A.气体反应物的总体积为0.448L |
| B.装置中氢元素的总质量为0.04g |
| C.生成物中含有0.01NA个分子 |
| D.生成物完全溶于永后所得溶液含有0.01 NA个NH4+ |
下列化学用语正确的是
A.重水的分子式: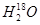 |
B.Mg2+的结构示意图: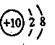 |
| C.乙酸的分子式:CH3COOH |
D.HCIO的电子式: |