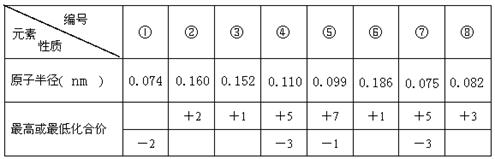
题目内容
右图是部分短周期元素的原子半径及主要化合价,根据表中信息,判断以下叙述正确的是( )
A.A2+与D2-的核外电子数相等
B.B与E形成的化合物具有两性
C.氢化物的稳定性为H2E<H2D
D.C单质与浓度相等的稀盐酸反应比A快
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
A.A2+与D2-的核外电子数相等
B.B与E形成的化合物具有两性
C.氢化物的稳定性为H2E<H2D
D.C单质与浓度相等的稀盐酸反应比A快
B
试题分析:共价元素的原子半径和主要化合价可知,A是Mg,B是Al,C是Be,D是S,E是O。A不正确,A2+与D2-的核外电子数不相等,分别是10电子和18电子。B正确,该化合物是氧化铝,属于两性氧化物。C不正确,非金属性是O大于S,所以氢化物的稳定性为H2E>H2D;Be的金属性弱于Mg的,与盐酸的反应速率小于镁和盐酸反应的反应速率,答案选B。
点评:该题是中等难度的试题,也是高考中的常见题型和考点。试题注重基础,兼顾能力的培养和解题方法的指导与训练。该题主要是以“周期表中元素的推断”为载体,比较全面考查学生有关元素推断知识和灵活运用知识的能力,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。

练习册系列答案
 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案
相关题目
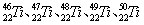 等。这些同位素原子的中子数不可能为
等。这些同位素原子的中子数不可能为