题目内容
(2008?北京)1mol过氧化钠与2mol碳酸氢钠固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是( )
分析:碳酸氢钠不稳定,加热易分解,发生2NaHCO3=Na2CO3+CO2↑+H2O,与过氧化钠可能发生2Na2O2+2H2O=4NaOH+O2,2Na2O2+2CO2=2Na2CO3+O2,结合物质的物质的量解答.
解答:解:根据反应式:2NaHCO3=Na2CO3+CO2↑+H2O,2Na2O2+2H2O=4NaOH+O2,2Na2O2+2CO2=2Na2CO3+O2;根据计量关系,可知2mol NaHCO3生成CO2和H2O各1mol,Na2O2只有1mol,故其恰好和CO2反应生成Na2CO3和O2,气体排出后,只剩余Na2CO3.
故选A.
故选A.
点评:本题考查过氧化钠与碳酸氢钠的性质及相关的化学反应,对于这类物质之间相互反应的题目,首先必须牢牢把握住物质的性质以及相互之间的反应,对于化学反应方程式应该“了如指掌”,注意把握相关物质的性质.

练习册系列答案
相关题目
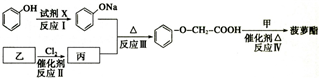
 是一种具有菠萝香气的食用香料,是化合物甲与苯氧乙酸发生化学反应的产物.
是一种具有菠萝香气的食用香料,是化合物甲与苯氧乙酸发生化学反应的产物.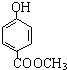




 CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O (2008?北京)X、Y、Z、W为含有相同电子数的分子或离子,均由原子序数小于10的元素组成,X有5个原子核.通常状况下,W为无色液体.
(2008?北京)X、Y、Z、W为含有相同电子数的分子或离子,均由原子序数小于10的元素组成,X有5个原子核.通常状况下,W为无色液体.