��Ŀ����
����Ŀ��ij�о���ѧϰС�������һ��ʵ����֤Ԫ�������ɣ�
��1����ͬѧ��a��b��c��ֻ�ձ���ֱ����50mLˮ���ٷֱ�μӼ��η�̪��Һ�����μ����С�����ﮡ��ơ��ؿ飬�۲�����ͬѧ���ʵ���Ŀ��������Ӧ����ҵ��� ��
��2����ͬѧ���ʵ����֤�ǽ���Ԫ�صķǽ�����Խǿ����Ӧ����ۺ���������Ծ�Խǿ�����������ͼװ������֤����̼����Ԫ�صķǽ�����ǿ���� ��ͬѧ��Ƶ�ʵ���ֱ��֤�������������ǿ������֪A��ǿ�ᣬ����ͭ��Ӧ��B�ǿ�״���壻��Һ©���Ļ����ɿ����д�������D�������ձ��пɹ۲쵽��ɫ����C���ɣ�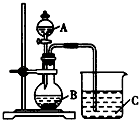
��i��д���������ʵĻ�ѧʽ��A��C��D ��
��ii��д���ձ��з�����Ӧ�����ӷ���ʽ�� ��
��iii��̼������������Ԫ�صķǽ�������ǿ����˳��Ϊ ��
��iv����ͬѧ��Ϊ��ͬѧ��Ƶ�ʵ�鲻���Ͻ���Ӧ����B��C֮������һ��ϴ��װ�ã���װ����Ӧʢ�������Լ�����
���𰸡�
��1���Ƚ�ﮡ��ơ��صĽ�����ǿ����c
��2��HNO3��Na2SiO3��CO2��CO2+SiO32��+H2O�TH2SiO3��+CO32����N��C��Si������NaHCO3
���������⣺��1���ɡ��о���ѧϰС�������һ��ʵ����֤Ԫ�������ɡ���֪����ͬѧ���ʵ���Ŀ������֤ﮡ��ơ��صĽ�����ǿ���� ������K��Na��Li��������Խǿ��������ˮ��ӦԽ���ң��ʷ�Ӧ����ҵ��ձ���C�����Դ��ǣ��Ƚ�ﮡ��ơ��صĽ�����ǿ����c����2����i������ǿ���Ʊ�������У�A��ǿ�ᣬ�����¿���ͭ��Ӧ�����B�ǿ�״���壬��Һ©���Ļ�����C�пɹ۲쵽��ɫ�������ɣ���BΪ̼��ơ�CΪ�����ƣ����Դ��ǣ�HNO3��Na2SiO3��CO2����ii���ձ��з�����Ӧ�����ӷ���ʽΪ��CO2+SiO32��+H2O�TH2SiO3��+CO32�� �� ���Դ��ǣ�CO2+SiO32��+H2O=CO32��+H2SiO3������iii��Ԫ�صķǽ�����Խǿ����Ӧ������������ˮ���������Խǿ����ʵ���֪���ԣ��������̼�ᣬ̼����ڹ��ᣬ��ǽ����ԣ�N��C��Si�����Դ��ǣ�N��C��Si����iv���������ӷ��������ɵĶ�����̼�����л���������������Ӧ�ñ���̼�����Ƴ�ȥ���ᣬ���Դ��ǣ�����NaHCO3 ��
�����㾫�������շǽ�����Ԫ�����ڱ��е�λ�ü������ʵݱ�Ĺ����ǽ����ĸ�������Ҫ֪����Ŀǰ��֪��112��Ԫ���У��ǽ���Ԫ����22�֣���H��ǽ���Ԫ�ض�λ�����ڱ������Ϸ���H�����Ϸ�����F�Ƿǽ�������ǿ��Ԫ�أ�

 ����ȫ���ִʾ��ƪ��ϵ�д�
����ȫ���ִʾ��ƪ��ϵ�д�