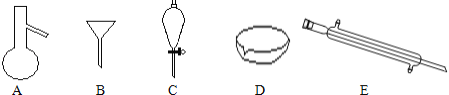题目内容
【题目】已知:FeCl3(aq)+3KSCN(aq)![]() 3KCl(aq)+Fe(SCN)3(aq),平衡时Fe(SCN)3的物质的量浓度与温度T的关系如图所示,则下列说法正确的是
3KCl(aq)+Fe(SCN)3(aq),平衡时Fe(SCN)3的物质的量浓度与温度T的关系如图所示,则下列说法正确的是
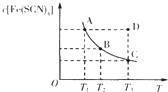
A.A点与B点相比,A点的c(Fe3+)大
B.加入KCl固体可以使溶液由D点变到C点
C.反应处于D点时,一定有υ(正)<υ(逆)
D.若T1、T2温度下的平衡常数分别为K1、K2,则K1<K2
【答案】C
【解析】
A.由图象可知,A点c[Fe(SCN)3]较大,则c(Fe3+)应较小,故A错误;
B.根据实际参加反应的离子浓度分析,化学平衡为Fe3++3SCN-![]() Fe(SCN)3,加入少量KCl固体,溶液中Fe3+、SCN-浓度不变,平衡不移动,故B错误;
Fe(SCN)3,加入少量KCl固体,溶液中Fe3+、SCN-浓度不变,平衡不移动,故B错误;
C.D在曲线上方,不是平衡状态,c[Fe(SCN)3]比平衡状态大,应向逆反应方向移动,V正<V逆,故C正确;
D.随着温度的升高c[Fe(SCN)3]逐渐减小,说明反应放热,升高温度平衡向逆反应方向移动即K也在变小,所以T1、T2温度下的平衡常数分别为K1、K2,则K1>K2,故D错误;
故选C。

练习册系列答案
相关题目
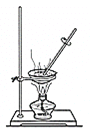
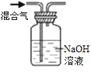
【题目】仅用下表提供的玻璃仪器(非玻璃仪器任选)或实验装置就能实现相应实验目的的是( )
选项 | A | B | C | D |
实验目的 | 除去KCl中少量的MnO2 | 用10mol·L-1的盐酸配制100mL0.1 mol·L-1的盐酸 | 用氯化钠溶液制备氯化钠晶体 | 除去CO2气体中的HCl |
实验仪器或装置 | 烧杯、玻璃棒、分液漏斗 | 100mL容量瓶、玻璃棒、烧杯 |
|
|
A.AB.BC.CD.D