题目内容
【题目】CaCO3广泛存在于自然界,是一种重要的化工原料。实验室用大理石(主要成分为CaCO3,另外有少量的含硫化合物)和稀盐酸反应制备CO2气体。下列装置可用于CO2气体的提纯和干燥。
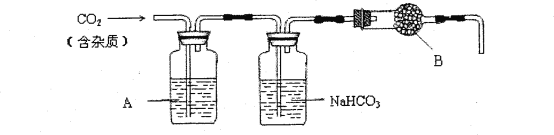
完成下列填空:
(1)用浓盐酸配制1:1(体积比)的稀盐酸(约6mol·L—1),应选用的仪器是____。
a.烧杯 b.玻璃棒 c.量筒 d.容量瓶
上述装置中,A是___溶液,NaHCO3溶液可以吸收____。上述装置中,B物质是____。用这个实验得到的气体测定CO2的分子量,如果B物质失效,测定结果____(填“偏高”、“偏低”或“不受影响”)。
(2)SiO2与CO2组成相似,但固体的熔点相差甚大,其原因是_____。
(3)饱和的Na2CO3溶液中通入过量CO2的离子方程式为_____。0.1mol/L的NaHCO3溶液中,c(Na+)+c(H+)=_____,其中有关碳微粒的关系为:____ =0.1mol/L。浓度相等的Na2CO3和NaHCO3溶液等体积混合后,溶液中离子浓度由大到小的关系为______。
【答案】abc CuSO4溶液或酸性KMnO4溶液 吸收HCl气体或吸收酸性气体 无水CaCl2 偏低 其原因是所属晶体类型不同,二氧化硅是原子晶体,熔化时破坏化学键,熔点高;二氧化碳是分子晶体,熔化时破坏的是分子间作用力,熔点低 2Na++CO32-+CO2+H2O=2NaHCO3↓ c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(HCO3-) c(CO32-)+c(HCO3-)+c(H2CO3) c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
【解析】
(1)配制一定体积比的溶液时,应选用烧杯、玻璃棒和量筒,用量筒量出相同体积的浓盐酸和水,倒入烧杯中,用玻璃棒搅拌加速溶解;根据实验所用药品,制得的气体中可能含有H2S、HCl和水蒸气;根据除杂的要求,除去H2S是可选用CuSO4溶液或酸性KMnO4溶液;碳酸氢钠溶液用于吸收HCl气体或吸收酸性气体;B是用来除去水份的,但这种干燥剂又不能与CO2反应所以是氯化钙;如果B中物质失效则二氧化碳中含有水,而水的相对分子质量小于二氧化碳,所以测定结果会偏低;
(2)二氧化硅与二氧化碳所属晶体类型不同,二氧化硅是原子晶体,熔化时破坏共价键,熔点高,而二氧化碳是分子晶体,熔化时破坏的是分子间作用力,熔点低,导致SiO2与CO2熔点相差甚大;
(3)向饱和Na2CO3溶液中通入足量CO2,发生反应Na2CO3+CO2+H2O=2NaHCO3,Na2CO3溶解度大于NaHCO3,则NaHCO3溶液为过饱和溶液,所以生成NaHCO3沉淀导致溶液变浑浊,离子方程式:2Na++CO32-+H2O+CO2=2NaHCO3↓;在0.1mol/L的NaHCO3溶液中,存在的电荷守恒式为c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),存在的物料守恒式为c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol/L;浓度相等的Na2CO3和NaHCO3溶液等体积混合后,溶液中Na+浓度最大,CO32-的水解程度大于HCO3-水解程度,即c(CO32-)<c(HCO3-),且溶液显碱性,即c(H+)<c(OH-),则溶液中各离子浓度的由大到小的关系为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)。

 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案【题目】在容积为1L的密闭容器中,发生反应N2+3H2![]() 2NH3△H<0,投入1molN2和3molH2分别在以下不同实验条件下进行反应。下列分析正确的是( )
2NH3△H<0,投入1molN2和3molH2分别在以下不同实验条件下进行反应。下列分析正确的是( )
容器编号 | 实验条件 | 平衡时反应中的能量变化 |
I | 恒温恒容 | 放热Q1kJ |
II | 恒温恒压 | 放热Q2kJ |
Ⅲ | 恒容绝热 | 放热Q3kJ |
A.放出热量:Q1>Q2
B.N2的转化率:I>Ⅲ
C.平衡时H2的浓度:I>Ⅲ
D.平衡时氨气的体积分数:I>II