题目内容
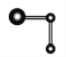
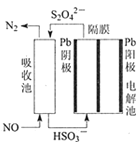
【题目】如下图所示,下列关于实验现象的描述正确的是( )

a电极 | b电极 | x溶液 | 实验现象 | |
A | 石墨 | 石墨 | CuCl2 | a电极质量增加,b电极放出无色气体 |
B | Fe | 石墨 | KNO3 | a电极质量增加,b电极放出无色气体 |
C | Fe | Cu | CuSO4 | a电极质量增加,b电极质量减少 |
D | 石墨 | 石墨 | HCl | A电极放出无色气体,b电极放出无色气体 |
A.AB.BC.CD.D
【答案】C
【解析】
A.a电极与电源负极相连,作阴极,铜离子放电,析出铜,质量增加,b电极是阳极氯离子放电产生黄绿色气体氯气,A错误;
B.铁与电源的负极相连,作阴极氢离子放电产生氢气,电极质量不变,b电极是阳极氢氧根放电产生氧气,B错误;
C.铁与电源的负极相连,作阴极铜离子放电析出铜,质量增加,铜与电源正极相连作阳极,铜失去电子质量减小,C正确;
D.a电极是阴极氢离子放电产生氢气,b电极是阳极氯离子放电产生黄绿色气体氯气,D错误;
答案选C。

练习册系列答案
相关题目