题目内容
【题目】![]() 是原子序数依次增大的前四周期元素。
是原子序数依次增大的前四周期元素。![]() 是宇宙中最丰富的元素;
是宇宙中最丰富的元素;![]() 元素原子基态时,核外电子均排布在3个能级上,且它们的价电子层上均有两个未成对电子;向含
元素原子基态时,核外电子均排布在3个能级上,且它们的价电子层上均有两个未成对电子;向含![]() 的溶液中滴加氨水,形成蓝色沉淀,再滴加氨水,沉淀溶解,得到深蓝色溶液。回答下列问题:
的溶液中滴加氨水,形成蓝色沉淀,再滴加氨水,沉淀溶解,得到深蓝色溶液。回答下列问题:
(1)第一电离能![]() ____
____![]() ,电负性
,电负性![]() ____
____![]() (填“大于”、“小于”或“等于”)
(填“大于”、“小于”或“等于”)
(2)写出与![]() 分子互为等电子体的一种离子的化学式_________。
分子互为等电子体的一种离子的化学式_________。
(3)若向含有![]() 的硫酸盐溶液中滴加过量氨水,得到深蓝色溶液后再加乙醇,有____________色晶体析出,该晶体中,中心离子的电子排布式为____________,配体为____________。
的硫酸盐溶液中滴加过量氨水,得到深蓝色溶液后再加乙醇,有____________色晶体析出,该晶体中,中心离子的电子排布式为____________,配体为____________。
(4)已知![]() 形成的一组二元化合物化学式:
形成的一组二元化合物化学式:![]() 、
、![]() 、
、![]() 、
、![]() 其中,
其中,![]() 分子中
分子中![]() 原子的杂化类型为___________;这组化合物的通式为________________。
原子的杂化类型为___________;这组化合物的通式为________________。
(5)已知![]() 和
和![]() 可以形成
可以形成![]() 和
和![]() 两种化合物,试根据有关信息完成下列问题:
两种化合物,试根据有关信息完成下列问题:
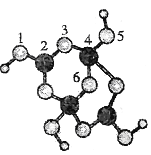
①用球棍模型表示的![]() 分子结构是_______________。
分子结构是_______________。
A.![]() B.
B.![]() C.
C.![]() D.
D.
②已知![]() 子的结构如图所示:
子的结构如图所示:![]() 分子不是直线形的,两个
分子不是直线形的,两个![]() 原子犹如在半展开的书的两面上,两个
原子犹如在半展开的书的两面上,两个![]() 原子在书脊位置上,书页夹角为
原子在书脊位置上,书页夹角为![]() ,而
,而![]() 键与
键与![]() 键的夹角均为
键的夹角均为![]() 。则
。则![]() 子的电子式为_________,结构式为_________,
子的电子式为_________,结构式为_________,![]() 分子是_______(填“极性”或“非极性”)分子。
分子是_______(填“极性”或“非极性”)分子。
【答案】大于 小于 ![]() 深蓝色
深蓝色 ![]()
![]() sp3杂化
sp3杂化 ![]() B
B ![]()
![]() 极性
极性
【解析】
![]() 是原子序数依次增大的前四周期元素。
是原子序数依次增大的前四周期元素。![]() 是宇宙中最丰富的元素,
是宇宙中最丰富的元素,![]() 是H;
是H;![]() 元素原子基态时,核外电子均排布在3个能级上,且它们的价电子层上均有两个未成对电子,X是C、Z是O;向含
元素原子基态时,核外电子均排布在3个能级上,且它们的价电子层上均有两个未成对电子,X是C、Z是O;向含![]() 的溶液中滴加氨水,形成蓝色沉淀,再滴加氨水,沉淀溶解,得到深蓝色溶液为四氨合铜,故Q是Cu。
的溶液中滴加氨水,形成蓝色沉淀,再滴加氨水,沉淀溶解,得到深蓝色溶液为四氨合铜,故Q是Cu。
(1)N元素原子的2p轨道为半满,稳定结构,能量较低,第一电离能高于同周期相邻元素的,则第一电离能N>O,同周期元素从左到右,元素的电负性逐渐增大,则电负性N<O;
(2)与CO互为等电子体微粒满足两个条件:含有2个原子、10个价电子,所以CO互为等电子体的微粒化学式为:N2、CN等;
(3)氨水和硫酸铜反应生成氢氧化铜蓝色沉淀,当氨水过量时,氨水和氢氧化铜反应生成可溶性的铜氨络合物,所以难溶物溶解得到深蓝色的透明溶液,涉及的离子方程式为:Cu2++2NH3H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH,再向深蓝色透明溶液加入乙醇,由于乙醇极性比水小,[Cu(NH3)4]SO4在乙醇中的溶解度小于在水中的溶解度,所以会析出深蓝色的晶体Cu(NH3)4SO4H2O,形成4个配位键,配体为NH3,中心离子的电子排布式为[Ar]3d9;
(4)NH3分子中N原子形成3个键,含有1对孤对电子,杂化轨道数目为4,N原子杂化方式为sp3杂化;根据已知分子式可知H原子数目比N原子多2,该物质组成通式为NnHn+2;
(5)①用球棍模型表示的![]() 分子(H2O)是极性分子,中心原子采取sp3杂化,是V形结构,故选B;②已知
分子(H2O)是极性分子,中心原子采取sp3杂化,是V形结构,故选B;②已知![]() 分子(H2O2)的结构如在翻开的书的两面上,H2O2的电子式为:
分子(H2O2)的结构如在翻开的书的两面上,H2O2的电子式为:![]() ;结构式为:
;结构式为:![]() ;H2O2中的化学键极性未抵消为零,故是极性分子。
;H2O2中的化学键极性未抵消为零,故是极性分子。

【题目】如下图所示,下列关于实验现象的描述正确的是( )
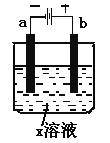
a电极 | b电极 | x溶液 | 实验现象 | |
A | 石墨 | 石墨 | CuCl2 | a电极质量增加,b电极放出无色气体 |
B | Fe | 石墨 | KNO3 | a电极质量增加,b电极放出无色气体 |
C | Fe | Cu | CuSO4 | a电极质量增加,b电极质量减少 |
D | 石墨 | 石墨 | HCl | A电极放出无色气体,b电极放出无色气体 |
A.AB.BC.CD.D