题目内容
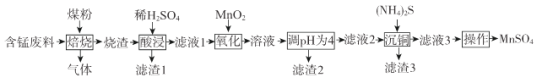
【题目】硫酸锰是一.种重要的化工原料,在农业、电化学和建筑等领域均有广泛应用。以含锰废料(含有MnO2 、CuO、Fe和少量CaO)为原料制备MnSO4的一种流程如下:
 已知:
已知:
I .烧渣中含有MnO、CuO、Cu、Fe、CaO。
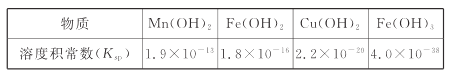
II.难溶电解质的溶度积常数如下表所示:
回答下列问题:
(1)“焙烧”过程加入煤粉的主要作用为___________________________。
(2)“酸浸”时所加稀H2SO4不宜过量太多的原因为______________________________.滤渣1的主要成分为_____________________(填化学式)。
(3)“氧化”过程中主要反应的离子方程式为__________________。
(4)“调pH为4”的目的为______________________;若“溶液”中c(Cu2+ )=0.022 mol/L,“滤液2”的体积是“溶液”体积的2倍,则“调pH为4”时Cu2+是否开始沉淀____________(通过计算说明)。
(5)(NH4)2S的电子式为___________________。
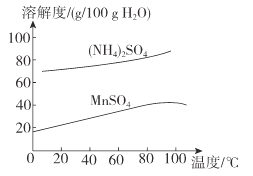
(6)已知:(NH4)2SO4与MnSO4的溶解度曲线如图所示。“操作”主要包括蒸发浓缩_______、过滤 、洗涤、干燥;其中用乙醇代替水洗涤的原因为__________,需控制温度为____( 填选项字母)得到产品最多。
A.10°C B.40 °C C.60 °C D.100°C
【答案】作还原剂 避免“调pH为4”时会消耗过多的碱 CaSO4、Cu MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O 将Fe3+转化为Fe(OH)3沉淀过滤除去 滤液2中c(Cu2+)=0.011 mol/L,c(OH-)=1×10-10 mol/L,则Qc[Cu(OH)2]=0.11×(1×10-10)2=1.1×10-22<Ksp c[Cu(OH)2],所以Cu2+未开始形成沉淀 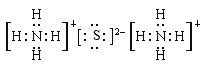 降温结晶 减少因溶解而造成的损失,且乙醇挥发带走水分,便于干燥 A
降温结晶 减少因溶解而造成的损失,且乙醇挥发带走水分,便于干燥 A
【解析】
含锰废料与煤粉在高温下混合,其中MnO2与C反应产生MnO,CuO与C反应产生Cu单质,同时得到含有CO的气体,得到的烧渣中含有MnO、CuO、Cu、Fe、CaO,然后同稀硫酸酸浸,其中MnO、CuO、Fe反应变为Mn2+、Cu2+、Fe2+,CaO反应产生溶解度较小的CaSO4进入滤渣1中,而Cu不能溶解,进入滤渣1,向滤液1中加入MnO2,可在酸性条件下氧化Fe2+为Fe3+,然后调节溶液的pH=4,可以使Fe3+转化为Fe(OH)3沉淀过滤除去,滤渣2成分为Fe(OH)3,向滤液2中加入(NH4)2S,其电离产生的S2-与溶液中Cu2+形成CuS沉淀过滤出去,进入滤渣3中,滤液3中含有的Mn2+、SO42-、NH4+等,根据溶解度曲线可知从滤液3中提取MnSO4采用的操作过程为:蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到MnSO4,结合乙醇易挥发,会带走水分,便于干燥,结合温度对物质溶解度的影响分析温度控制范围。
(1)由流程中物质转化关系可知在焙烧时加入煤粉可以与MnO2反应转化为MnO,因此煤粉的作用是作还原剂;
(2)“酸浸”时所加稀H2SO4不宜过量太多的原因是若过多,调节pH=4时就会消耗过多的碱,由信息可知加入稀硫酸可将CaO转化为CaSO4,同时焙烧时CuO转化为Cu不溶于稀硫酸,故滤渣1的主要成分是CaSO4和Cu;
(3)“氧化”过程中MnO2在酸性条件下将Fe2+氧化为Fe3+,主要反应的离子方程式为MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
(4)“调pH为4”的目的是将Fe3+转化为Fe(OH)3沉淀过滤除去。滤液2的体积是溶液体积的2倍,则滤液2中c(Cu2+)=0.011 mol/L,c(OH-)=![]() mol/L=1×10-10 mol/L,则Qc[Cu(OH)2]=0.011×(1×10-10)2=1.1×10-22<Ksp c[Cu(OH)2],所以Cu2+未开始形成沉淀;
mol/L=1×10-10 mol/L,则Qc[Cu(OH)2]=0.011×(1×10-10)2=1.1×10-22<Ksp c[Cu(OH)2],所以Cu2+未开始形成沉淀;
(5)(NH4)2S是离子化合物,由NH4+与S2-通过离子键结合而成,其电子式为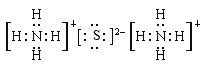 ;
;
(6)由溶解度曲线可知:从滤液3中提取MnSO4的操作主要包括蒸发浓缩、降温结晶、过滤、洗涤、干燥。MnSO4易溶于水,用乙醇代替水洗涤就可以减少因溶解而造成的损失,且乙醇易挥发带走水分,便于干燥,根据溶解度曲线可知温度可知在10℃时所得产品最多,故合理选项是A。

 名校课堂系列答案
名校课堂系列答案【题目】如下图所示,下列关于实验现象的描述正确的是( )

a电极 | b电极 | x溶液 | 实验现象 | |
A | 石墨 | 石墨 | CuCl2 | a电极质量增加,b电极放出无色气体 |
B | Fe | 石墨 | KNO3 | a电极质量增加,b电极放出无色气体 |
C | Fe | Cu | CuSO4 | a电极质量增加,b电极质量减少 |
D | 石墨 | 石墨 | HCl | A电极放出无色气体,b电极放出无色气体 |
A.AB.BC.CD.D