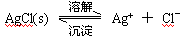题目内容
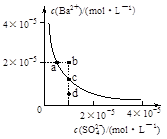
常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图。下列说法正确的是
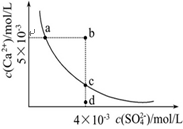
常温下,向100mL CaSO4饱和溶液中,加入400mL 0.01mol/LNa2SO4溶液后,溶液中有沉淀析出
B.b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×10-3 mol/L
C.d点溶液通过蒸发可以变到c点
D.a点对应的Ksp等于c点对应的Ksp

常温下,向100mL CaSO4饱和溶液中,加入400mL 0.01mol/LNa2SO4溶液后,溶液中有沉淀析出
B.b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×10-3 mol/L
C.d点溶液通过蒸发可以变到c点
D.a点对应的Ksp等于c点对应的Ksp
D
A、常温下CaS04饱和溶液中,c(Ca2+)?c(SO42-)=Ksp,Ksp(CaS04)=9×l0-6,c(Ca2+)=c(SO42-)=3×l0-3,故A错误;
B、根据图示数据,可以看出b点Qc=2×l0-5>Ksp,所以会生成沉淀,平衡向生成沉淀的方向进行,此时溶液中c(SO4-)会小于4×l0-3mol/L,不一定等于3×l0-3mol/L,故B错误;
C、升高温度,有利于溶解平衡正向移动,所以硫酸根的浓度会增大,故C错误;
D、a、c点均是常温下CaS04在水中的沉淀溶解平衡曲线上的点,所以a点对应的Ksp等于c点对应的Ksp,故D正确.
故选D.
点评:本题考查学生难溶电解质的溶解平衡知识,结合图象考查,增加了难度,注意知识的积累是解题关键.
B、根据图示数据,可以看出b点Qc=2×l0-5>Ksp,所以会生成沉淀,平衡向生成沉淀的方向进行,此时溶液中c(SO4-)会小于4×l0-3mol/L,不一定等于3×l0-3mol/L,故B错误;
C、升高温度,有利于溶解平衡正向移动,所以硫酸根的浓度会增大,故C错误;
D、a、c点均是常温下CaS04在水中的沉淀溶解平衡曲线上的点,所以a点对应的Ksp等于c点对应的Ksp,故D正确.
故选D.
点评:本题考查学生难溶电解质的溶解平衡知识,结合图象考查,增加了难度,注意知识的积累是解题关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

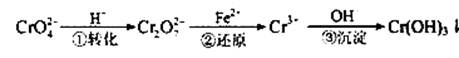
 Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O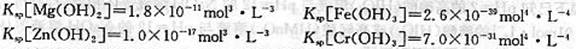
 mAn+(aq)+nBm-(aq) [An+]m·[Bm-]n=Ksp
mAn+(aq)+nBm-(aq) [An+]m·[Bm-]n=Ksp