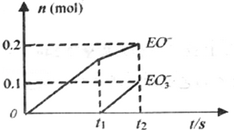
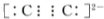题目内容
8.在下列反应中,HCl既表现酸性又表现氧化性的是( )| A. | CaCO3+2HCl=CaCl2+H2O+CO2↑ | |
| B. | Fe+2HCl═FeCl2+H2↑ | |
| C. | MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑ | |
| D. | NaOH+HCl=NaCl+H2O |
分析 HCl既表现酸性又表现氧化性,H元素的化合价降低,则生成盐和氢气,以此来解答.
解答 解:A.只表现酸性,故A不选;
B.生成氯化亚铁,体现其酸性,生成氢气体现其氧化性,故B选;
C.生成氯气,体现其还原性,故C不选;
D.只表现酸性,故D不选;
故选B.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意从元素的化合价角度分析,题目难度不大.

练习册系列答案
相关题目
12.下列有关仪器的使用正确的是( )
| A. | 做金属钠与水反应实验时,剩余的钠不能再放入原试剂瓶 | |
| B. | 配制480mLNaOH溶液需要的主要仪器有480mL容量瓶、玻璃棒、烧杯、量筒等 | |
| C. | 将固体药品放在蒸发皿中进行高温焙烧 | |
| D. | 冷凝管中冷却水的流向一定是下口进水、上口出水 |
19.开发、使用清洁能源发展“低碳经济”,正成为科学家研究的主要课题.氢气、甲醇是优质的清洁燃料
Ⅰ、已知:①2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(g)△H1=-1275.6kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ/mol
③H2O(g)=H2O(1)△H3=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:CH3OH(1)+O2(g)=CO(g)+2H2O(1)△H=-442.8kJ•mol-1.
Ⅱ、工业上采用下列反应合成甲醇:CO(g)+2H2(g)═CH3OH(g)△H=Q kJ/mol
(1)下列一定能说明该可逆反应达到化学平衡状态的是(填字母序号)CD.
A.生成CH3OH的速率与消耗CO的速率相等 B.混合气体的密度不变
C.CH3OH、CO、H2的浓度都不再发生变化 D.混合气体的平均相对分子质量不变
(2)如表所列数据是该可逆反应在不同温度下的化学平衡常数(K).
①由表中数据判断Q<0(填“>”、“<”或“=”).
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡测得c(CO)=0.2mol/L,此时对应的温度为250℃℃;CO的转化率为80%;
(3)一定温度下,将1mol CO和3molH2分别充入容积均为1L的甲(恒压)、乙(恒容)密闭容器中.若经过60s乙容器中反应达到平衡,则甲容器中达到平衡时所需的时间<60s(填“>”、“<”或“=”).
(4)要提高CO的转化率并且提高反应速率,可采取的措施是D(填字母).
A.升温 B.加入催化剂 C.增加CO的浓度
D.体积不变通入H2 E.体积不变通入惰性气体 F.分离出甲醇.
Ⅰ、已知:①2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(g)△H1=-1275.6kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ/mol
③H2O(g)=H2O(1)△H3=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:CH3OH(1)+O2(g)=CO(g)+2H2O(1)△H=-442.8kJ•mol-1.
Ⅱ、工业上采用下列反应合成甲醇:CO(g)+2H2(g)═CH3OH(g)△H=Q kJ/mol
(1)下列一定能说明该可逆反应达到化学平衡状态的是(填字母序号)CD.
A.生成CH3OH的速率与消耗CO的速率相等 B.混合气体的密度不变
C.CH3OH、CO、H2的浓度都不再发生变化 D.混合气体的平均相对分子质量不变
(2)如表所列数据是该可逆反应在不同温度下的化学平衡常数(K).
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡测得c(CO)=0.2mol/L,此时对应的温度为250℃℃;CO的转化率为80%;
(3)一定温度下,将1mol CO和3molH2分别充入容积均为1L的甲(恒压)、乙(恒容)密闭容器中.若经过60s乙容器中反应达到平衡,则甲容器中达到平衡时所需的时间<60s(填“>”、“<”或“=”).
(4)要提高CO的转化率并且提高反应速率,可采取的措施是D(填字母).
A.升温 B.加入催化剂 C.增加CO的浓度
D.体积不变通入H2 E.体积不变通入惰性气体 F.分离出甲醇.
16.设NA为阿佛加德罗常数,下列对于0.3mol/L的K2SO4溶液的说法中正确的是( )
| A. | 溶液中含有0.6NA个K+ | |
| B. | 1L溶液中含有K+和SO42-总数为0.9NA | |
| C. | 取出10mL该溶液中,K+浓度为0.3mol/L | |
| D. | 100mL溶液中含有SO42-数目为0.6NA |
3.下列说法正确的是( )
| A. | 酿酒过程中,葡萄糖可通过水解反应生成酒精 | |
| B. | 工业上利用油脂生产肥皂、用淀粉酿酒、用纤维素生产酒精 | |
| C. | 酸性高锰酸钾紫色溶液中加入植物油充分振荡后,溶液颜色不会因反应褪去 | |
| D. | 蛋白质和油脂在发生腐败变质时,均会产生含NH3的刺激性气味 |
13.用NA表示阿伏伽德罗常数的值,下列判断正确的是( )
| A. | 18gH2O含有的氢原子数目为NA | |
| B. | 标准状况下,22.4LCO2含有的分子数目为NA | |
| C. | 常温常压下,1.06gNaCO3含有的分子数目为0.02NA | |
| D. | 1L1mol/L的KClO3溶液中含有的Cl-个数为NA |
17.下列反应既是氧化还原反应,又是吸热反应是( )
| A. | 实验室制备氢气 | |
| B. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应 | |
| C. | 灼热的木炭与CO2的反应 | |
| D. | 铝粉与氧化铁粉末反应 |
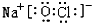 .
.