题目内容
20.有A、B、C、D、E、F六种短周期元素,其中A 的一种原子不含中子;B 的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子;C元素的一种气体单质呈蓝色,D与B同周期,该周期中D的简单离子半径最小;E的单质是一种本身有毒可以用来消毒的气体;F 元素最高正价与最低负价的代数和为4.(1)B、C、E 三元素组成的化合物之一,是家用消毒剂的主要成分,所含的化学键有离子键、共价键,其电子式为
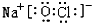 .
.(2)D、E、F 的简单离子半径由大到小的顺序是S2->Cl->Al3+(用离子符号表示).
(3)两种均含A、B、C、F 四种元素的化合物在溶液中相互反应的离子方程式H++HSO3-=SO2↑+H2O.
(4)A、B 形成的化合物BA 在有机合成中用途很广泛.它可以夺取很多化合物中的质子而生成相应的钠的化合物.写出它与乙醇反应的化学方程式NaH+CH3CH2OH→CH3CH2ONa+H2↑.
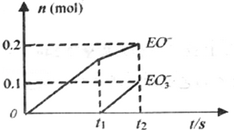
(5)一定量的石灰乳中通入一定量的E单质,两者恰好完全反应,生成物中有三种含E元素的离子.其中两种离子的物质的量(n) 与反应时间(t)的曲线如图所示.
则t2时刻消耗氢氧化钙质量为37g,此时反应的化学方程为10Cl2+10Ca(OH)2=7CaCl2+2Ca(ClO)2+Ca(ClO3)2+10H2O.
分析 有A、B、C、D、E、F六种短周期元素,A 的一种原子不含中子,则A为H元素;B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子,B为Na;C元素的一种气体单质呈蓝色,则C为O元素;D与B同周期,该周期中D的简单离子半径最小,则D为Al;E的单质是一种本身有毒可以用来消毒的气体,则E为Cl;F 元素最高正价与最低负价的代数和为4,处于VIA族,则F为S元素,据此解答.
解答 解:有A、B、C、D、E、F六种短周期元素,A 的一种原子不含中子,则A为H元素;B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子,B为Na;C元素的一种气体单质呈蓝色,则C为O元素;D与B同周期,该周期中D的简单离子半径最小,则D为Al;E的单质是一种本身有毒可以用来消毒的气体,则E为Cl;F 元素最高正价与最低负价的代数和为4,处于VIA族,则F为S元素.
(1)B、C、E 三元素组成的化合物之一,是家用消毒剂的主要成分,该化合物为NaClO,含有离子键、共价键,电子式为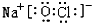 ,
,
故答案为:离子键、共价键;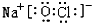 ;
;
(2)电子层结构相同核电荷数越大,离子半径越小,电子层越多离子半径越大,故离子半径由大到小的顺序是:S2->Cl->Al3+,
故答案为:S2->Cl->Al3+;
(3)两种均含H、Na、O、S四种元素的化合物在溶液中能相互反应,应是亚硫酸氢钠与硫酸氢钠,反应离子方程式为:H++HSO3-=SO2↑+H2O,
故答案为:H++HSO3-=SO2↑+H2O;
(4)H、Na形成的化合物NaH在有机合成中用途很广泛,它可以夺取很多化合物中的质子而生成相应的钠的化合物,它与乙醇反应的化学方程式为:NaH+CH3CH2OH→CH3CH2ONa+H2↑,
故答案为:NaH+CH3CH2OH→CH3CH2ONa+H2↑;
(5)根据图象知,次氯酸根离子的物质的量为0.2mol,氯酸根离子的物质的量为0.1mol,所以次氯酸根离子的物质的量与氯酸根离子的物质的量之比为2:1,根据得失电子守恒知,氯气和氢氧化钙的反应方程式为:10Cl2+10Ca(OH)2=7CaCl2+2Ca(ClO)2+Ca(ClO3)2+10H2O,则t2时刻生成Ca(ClO)2为0.1mol,则消耗氢氧化钙为0.1mol×$\frac{10}{2}$=0.5mol,其质量为0.5mol×74g/mol=37g,
故答案为:37;10Cl2+10Ca(OH)2=7CaCl2+2Ca(ClO)2+Ca(ClO3)2+10H2O.
点评 本题考查结构性质位置关系应用,正确推断元素是解题关键,侧重考查学生对知识的迁移运用能力考查,难度中等.

| A. | 0.1 mol•L-1(NH4)2SO4溶液:(NH4+)>c(S042-)>c(H+)>(0H-) | |
| B. | 浓度均为0.1 mol•L-1的Na2CO3和NaHCO3等体积混合后的溶液:(Na+)>c(CO32-)>c(HCO3-)>(0H-) | |
| C. | 浓度均为0.1 mol•L-1NH3•H2O和NH4Cl等体积混合后的溶液:c(Cl-)>c(NH4+)>c(NH3•H2O) | |
| D. | 0.1 mol•L-1(Na)2S溶液:(0H-)=c(H+)+c(HS-)+c(H2S) |
| A. | C | B. | C3H8 | C. | C2H4O | D. | C3H6 |
| A. | CaCO3+2HCl=CaCl2+H2O+CO2↑ | |
| B. | Fe+2HCl═FeCl2+H2↑ | |
| C. | MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑ | |
| D. | NaOH+HCl=NaCl+H2O |
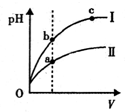
| A. | 将浓度为0.1 mol•L-1 HF溶液加水不断稀释过程中,K(HF)保持不变 | |
| B. | 等物质的量浓度的 NH4HSO4溶液和NaOH溶液等体积混合,溶液中各离子浓度大小关系为:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 已知298K时氢氰酸(HCN)的Ka=4.9×10-10、碳酸的Ka1=4.4×10-7,Ka2=4.7×10-11,据此可推测将氢氰酸加入到碳酸钠溶液中能观察到有气泡产生 | |
| D. | 某温度下,相同体积、相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积V变化的曲线如图所示.II为醋酸稀释时pH的变化曲线,且a、b两点水的电离程度:a<b |
| A. | 2.3g钠与水反应失去的电子数目为0.2NA | |
| B. | 20℃、101Kpa时,5.6L氨气所含的原子数目为NA | |
| C. | 0℃、101Kpa时,18g铵根离子所含有的电子数为10NA | |
| D. | 1mol氯化钠固体溶于1L水所得的溶液中氯化钠的物质的量浓度为1mol/L |
| A. | 13.5L | B. | 9.0L | C. | 16.8L | D. | 15.7L |
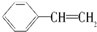 ,它一般不可能具有的性质是( )
,它一般不可能具有的性质是( )| A. | 易溶于水,不易溶于有机溶剂 | |
| B. | 在空气中燃烧产生浓烟 | |
| C. | 所有的原子可能共平面 | |
| D. | 能与浓硝酸在浓H2SO4作用下发生取代反应 |