题目内容
17.下列反应既是氧化还原反应,又是吸热反应是( )| A. | 实验室制备氢气 | |
| B. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应 | |
| C. | 灼热的木炭与CO2的反应 | |
| D. | 铝粉与氧化铁粉末反应 |
分析 有化合价变化的反应是氧化还原反应.大多数的分解反应是吸热反应,焦炭和二氧化碳的反应是吸热反应.
解答 解:A、锌粒与稀盐酸的反应是氧化还原反应,又是放热反应,故A错误;
B、Ba(OH)2•8H2O与NH4Cl的反应属于吸热反应但是不是氧化还原反应,故B错误;
C、灼热的炭与CO2的反应既属于氧化还原反应,又是吸热反应,故C正确;
D、铝粉与氧化铁粉末反应属于放热反应,也是氧化还原反应,故D错误.
故选C.
点评 本题考查学生氧化还原反应的概念和常见的吸热和放热反应知识,侧重于学生的分析能力的考查,注意把握元素化合价的变化,为解答该题的关键,难度不大.

练习册系列答案
相关题目
7.相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
实验测得起始、平衡时的有关数据如下表:
下列叙述正确的是( )
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
实验测得起始、平衡时的有关数据如下表:
| 容器编号 | 起始时各物质物质的量/mol | 平衡时反应中的能量变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量a kJ |
| ② | 2 | 3 | 0 | 放出热量b kJ |
| ③ | 2 | 6 | 0 | 放出热量c kJ |
| A. | N2的转化率:②>①>③ | B. | 三个容器内反应的平衡常数:③>①>② | ||
| C. | 平衡时氨气的体积分数:①>③ | D. | 放出热量关系:2a<c<184.8 kJ |
8.在下列反应中,HCl既表现酸性又表现氧化性的是( )
| A. | CaCO3+2HCl=CaCl2+H2O+CO2↑ | |
| B. | Fe+2HCl═FeCl2+H2↑ | |
| C. | MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑ | |
| D. | NaOH+HCl=NaCl+H2O |
5.下列说法不正确的是( )
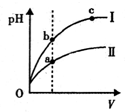

| A. | 将浓度为0.1 mol•L-1 HF溶液加水不断稀释过程中,K(HF)保持不变 | |
| B. | 等物质的量浓度的 NH4HSO4溶液和NaOH溶液等体积混合,溶液中各离子浓度大小关系为:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 已知298K时氢氰酸(HCN)的Ka=4.9×10-10、碳酸的Ka1=4.4×10-7,Ka2=4.7×10-11,据此可推测将氢氰酸加入到碳酸钠溶液中能观察到有气泡产生 | |
| D. | 某温度下,相同体积、相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积V变化的曲线如图所示.II为醋酸稀释时pH的变化曲线,且a、b两点水的电离程度:a<b |
12.设NA代表阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 2.3g钠与水反应失去的电子数目为0.2NA | |
| B. | 20℃、101Kpa时,5.6L氨气所含的原子数目为NA | |
| C. | 0℃、101Kpa时,18g铵根离子所含有的电子数为10NA | |
| D. | 1mol氯化钠固体溶于1L水所得的溶液中氯化钠的物质的量浓度为1mol/L |
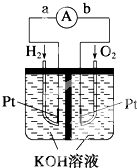 氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀了一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答:
氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀了一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答: