题目内容
【题目】金属钛在航天、潜海和医疗方面应用广泛。工业上用钛铁矿(主要成分为钛酸亚铁FeTiO3,含FeO、Fe2O3、SiO2)为原料制TiO2,再由TiO2制得金属Ti

资料:TiO2+会发生水解
(1)步骤②、③、④中,均需用到的操作是_______。(填操作名称)
(2)检验滤液2中是否含Fe3+的方法是:_______。
(3)步骤1中FeTiO3溶于过量硫酸的化学方程式___________。

(4)请结合化学用语解释步骤④中加热水的原因___________。
(5)电解法获得Ti是通过图装置,以熔融CaCl2做电解质
①a为电源的_____(填“正”或“负”)
②在制备钛的过程中石墨电极附近的气泡中除了O2、CO、CO2外还可能有的气体是______________,用化学用语解释原因________________。
(6)测定废液中Fe2+浓度已确认铁元素的回收率:取25.00ml废液于锥形瓶中,用硫酸酸化的xmol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积如图所示:
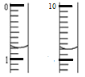
(滴定时发生反应的离子方程式为:5Fe2++MnO4-+8H+→5Fe3++Mn2++4H2O).废液中c(Fe2+)=_________
【答案】过滤 取1—2mL滤液2,滴加KSCN溶液,变红,有Fe3+ FeTiO3 + 2H2SO4 = FeSO4 + TiOSO4 + 2H2O TiO2+ + 2H2O![]() H2TiO3 + 2H+,水解反应吸热,用热水促进反应向正向进行 负 Cl2 2Cl-— 2e-= Cl2↑ 2xmolL—1
H2TiO3 + 2H+,水解反应吸热,用热水促进反应向正向进行 负 Cl2 2Cl-— 2e-= Cl2↑ 2xmolL—1
【解析】
钛铁矿(主要成分为钛酸亚铁FeTiO3,含FeO、Fe2O3、SiO2)在353K时用硫酸溶解,FeTiO3、FeO和Fe2O3溶于硫酸生成硫酸铁、硫酸亚铁和TiOSO4,二氧化硅不溶,过滤除去;滤液1中加入过量铁粉,将Fe3+还原为Fe2+,过滤出不溶性物质,得到滤液2,经冷却结晶得到硫酸亚铁晶体,过滤后得滤液3,滤液3中含有TiOSO4加入热水促进水解经过滤得到H2TiO3固体,煅烧H2TiO3制TiO2,TiO2通过电解得到Ti。
(1) 步骤②、③、④操作过程中都得到沉淀或晶体,故需要过滤操作得到固体和溶液,
故答案为:过滤;
(2)检验Fe3+的方法是:取1—2mL滤液2,滴加KSCN溶液,变红,说明有Fe3+,
故答案为:取1—2mL滤液2,滴加KSCN溶液,变红,有Fe3+;
(3)由流程图可知,步骤1中FeTiO3溶于过量硫酸生成TiOSO4、FeSO4和水,化学方程式为:FeTiO3 + 2H2SO4 = FeSO4 + TiOSO4 + 2H2O;
(4) TiO2+在溶液中水解,溶液中存在平衡:TiO2+ + 2H2O![]() H2TiO3 + 2H+,水解反应一般为吸热反应,当加入热水,稀释、升温平衡正向移动,有利于生成H2TiO3。
H2TiO3 + 2H+,水解反应一般为吸热反应,当加入热水,稀释、升温平衡正向移动,有利于生成H2TiO3。
故答案为:TiO2+ + 2H2O![]() H2TiO3 + 2H+,水解反应吸热,用热水促进反应向正向进行;
H2TiO3 + 2H+,水解反应吸热,用热水促进反应向正向进行;
(5)①由图可知,制取Ti,用石墨作阳极、TiO2作阴极、熔融CaCl2作电解质,阳极发生氧化反应,阴极发生还原反应,电解池的阴极要与电源的负极连接,故a为电源的负极,
故答案为:负极;
②由图示阳极产物可知,阳极生成二氧化碳气体,是电解质中的氧离子失电子生成氧气,氧气和阳极石墨反应生成的二氧化碳或一氧化碳,同时氯离子也可以失电子生成氯气,电极反应为:2Cl-— 2e-= Cl2↑,
故答案为:2Cl-— 2e- = Cl2↑;
(6)由图可知滴定管的初读数为0.80mL,末读数为10.80mL,所以滴定时消耗KMnO4溶液体积为:10.80mL-0.80mL=10.00mL,
根据滴定时发生反应的离子方程式: 5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,
n(Fe2+)=5n(MnO4-)=5×xmol/L×0.01L=0.05xmol,
所以c(Fe2+)= ![]() =2xmolL—1,
=2xmolL—1,
故答案为:2xmolL—1。

【题目】实验室可用氯气与一氧化氮在常温常压条件下合成亚硝酰氯(NOCl)。已知亚硝酰氯是一种黄色气体,熔点:-64.5℃,沸点:-5.5℃,遇水易反应生成一种无氧酸和两种氮的常见氧化物
(1)甲组同学拟制备原料气NO和Cl2制备装置如图所示

①为制备并得到纯净干燥的气体,补充下表中缺少的药品。
装置I中药品 | 装置II中药品 | ||
蒸馏烧瓶 | a仪器 | ||
制备纯净Cl2 | KmnO4 | 浓盐酸 | (i)___________ |
制备纯净的NO | Cu | (ii)__________ | 水 |
②仪器a的名称为____;装置Ⅲ的作用是______________。
(2)乙组同学对甲组同学制取NO的装置略加改良,利用甲组制得的Cl2共同制备NOCl,装置如下图所示

①组装好实验装置,检查气密性,依次装入药品。此实验关健操作有两点:I将Cl2充满D装置的三颈瓶;Ⅱ,A中反应开始时,先关闭K2,打开K1,待NO充满装置后关闭K1,打开K2。这两步操作都要“充满”,目的是__________。
②装置B中水的作用是___________________(用化学方程式表示)。
③若装置C中压强过大,可以观察到的现象是________________。
④装置D中冰盐水的作用是___________________________。
⑤如果去掉盛有浓硫酸的C、装有无水CaCl2的E两装置,对该实验的主要影响是________(用化学方程式表示)。


