题目内容
【题目】实验室可用氯气与一氧化氮在常温常压条件下合成亚硝酰氯(NOCl)。已知亚硝酰氯是一种黄色气体,熔点:-64.5℃,沸点:-5.5℃,遇水易反应生成一种无氧酸和两种氮的常见氧化物
(1)甲组同学拟制备原料气NO和Cl2制备装置如图所示

①为制备并得到纯净干燥的气体,补充下表中缺少的药品。
装置I中药品 | 装置II中药品 | ||
蒸馏烧瓶 | a仪器 | ||
制备纯净Cl2 | KmnO4 | 浓盐酸 | (i)___________ |
制备纯净的NO | Cu | (ii)__________ | 水 |
②仪器a的名称为____;装置Ⅲ的作用是______________。
(2)乙组同学对甲组同学制取NO的装置略加改良,利用甲组制得的Cl2共同制备NOCl,装置如下图所示

①组装好实验装置,检查气密性,依次装入药品。此实验关健操作有两点:I将Cl2充满D装置的三颈瓶;Ⅱ,A中反应开始时,先关闭K2,打开K1,待NO充满装置后关闭K1,打开K2。这两步操作都要“充满”,目的是__________。
②装置B中水的作用是___________________(用化学方程式表示)。
③若装置C中压强过大,可以观察到的现象是________________。
④装置D中冰盐水的作用是___________________________。
⑤如果去掉盛有浓硫酸的C、装有无水CaCl2的E两装置,对该实验的主要影响是________(用化学方程式表示)。
【答案】饱和食盐水 或:饱和NaCl溶液 稀硝酸 或:稀HNO3 分液漏斗 干燥NO或Cl2 或: 除去NO或Cl2中的水蒸气 排尽装置中的空气 3NO2+H2O==2HNO3+NO 长颈漏斗中的液面上升 液化亚硝酰氯,便于产品收集 2NOCl+H2O==2HCl+NO↑+NO2↑
【解析】
(1)①制备纯净氯气,根据装置图,图I制备出的氯气含有HCl和H2O,装置Ⅱ的作用是吸收HCl,盛放试剂是饱和食盐水;制备纯净的NO,利用铜和稀硝酸的反应,分液漏斗中盛放的是稀硝酸;
②仪器a为分液漏斗,根据实验目的,装置Ⅲ的作用是干燥NO和Cl2;
(2)①两步操作都要“充满”的目的是排尽装置中空气;
②装置A产生NO,NO与烧瓶中O2发生反应生成NO2,装置B的作用是吸收NO2,发生3NO2+H2O=2HNO3+NO;
③压强过大,装置C中长颈漏斗中的液面上升;
④依据实验目的,以及亚硝酰氯的物理性质,装置D中冰盐水的作用是液化亚硝酰氯,便于产品收集;
⑤浓硫酸C干燥NO气体,无水CaCl2的作用是防止空气水蒸气进入装置D,亚硝酰氯遇水反应生成一种无氧酸和两种氮的常见氧化物,因此缺少这两个装置后,发生2NOCl+H2O=2HCl+NO↑+NO2↑。

【题目】砂质土壤分析中常用 Karl Fischer法是测定其中微量水含量,该方法是利用I2和SO2反应定量消耗水作为原理(假设土壤中其他成分不参加反应),据此回答下列问题:
(1)写出该反应的化学反应方程式:_______________________。
步骤I:反应样品中的水
下图是某同学在实验室模拟Karl Fischer法的实验装置图:

(2)装置连接的顺序为a→____________(填接口字母顺序);M仪器的名称为________________,其在实验过程中的作用是:____________;
(3)操作步骤为:①连接装置并检查装置气密性,②装入药品,____________________;③关闭弹簧夹,打开分液漏斗活塞;④反应结束后,关闭分液漏斗活塞,继续通入N2,⑤取下D装置,···
步骤④中继续通入N2的目的是________________________________
步骤 II:测定剩余的碘
向反应后的D装置加入蒸馏水,过滤,充分洗涤,并合并洗涤液和滤液,将其配成250.00mL溶液,取25.00mL用0.20mol·L-1 Na2S2O3标准液滴定剩余的I2单质,已知反应如下:2S2O32-+I2=S4O62-+2I-。
(4)Na2S2O3标准液应装在_____________(填“酸式”、“碱式”)滴定管中;上述操作中,合并洗涤液和滤液的目的是__________________________;
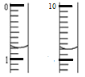
(5)滴定实验重复四次得到数据如下:
实验 | ① | ② | ③ | ④ |
消耗的标准液的体积/mL | 18.37 | 20.05 | 19.95 | 20.00 |
①若实验开始时,向D装置中加入10.00 g土壤样品和10.16克I2(已知I2过量),则样品土壤中水的含量为_________%。
②若Na2S2O3标准液已部分氧化变质,则水含量测定结果将____________(填“偏高”、“ 偏低”或“不变”)。