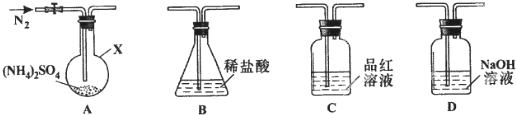
题目内容
4.一定量的稀硫酸与过量的锌反应,为减慢反应速率,且不影响生成氢气的总量,可向稀硫酸中加入适量的下列物质,其中能达到目的是( )| A. | 硝酸钠固体 | B. | 冰醋酸 | C. | 硫酸锌溶液 | D. | 硫酸铜固体 |
分析 Zn过量,生成氢气由硫酸决定,则减小氢离子浓度,不改变其物质的量,则可减慢反应速率,且不影响生成氢气的总量,以此来解答.
解答 解:A.加入硝酸钠,硝酸根离子在酸性条件下具有强氧化性,不生成氢气,故A错误;
B.加入醋酸,氢离子浓度增大,反应速率增大,生成氢气的量增多,故B错误;
C.氢离子浓度减小,反应速率减慢,但氢离子物质的量不变,则生成氢气总量不变,能达到目的,故C正确;
D.加入少量CuSO4固体,构成原电池,加快反应速率,不达到目的,故D错误.
故选C.
点评 本题考查化学反应速率的影响因素,为高频考点,把握温度、浓度、原电池对反应速率的影响即可解答,注重基础知识的考查,题目难度不大.

练习册系列答案
相关题目
14.化学科学对提高人类生活质量和促进社会发展具有重要作用,下列说法中正确的是( )
| A. | 煤经过气化和液化两个物理变化,可变为清洁能源 | |
| B. | 自然界中含有大量的游离态的硅,纯净的硅晶体可用于制作计算机芯片 | |
| C. | 汽车尾气的大量排放影响了空气的质量,是造成PM2.5值升高的原因之一 | |
| D. | 明矾和氯气均可用于水的杀菌、消毒 |
19.用氢氧化钠固体配制一定物质的量浓度溶液,下列情况使结果偏低的是( )
| A. | 容量瓶内含少量水 | B. | 氢氧化钠中含有少量碳酸钠 | ||
| C. | 俯视定容 | D. | 溶解后立即定容 |
16.甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸汽重整.向反应系统同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:
回答下列问题:
(1)反应CO(g)+H2O(g)═CO2(g)+H2(g)的△H=-41.2kJ•mol-1.
(2)在初始阶段,甲烷蒸汽重整的反应速率小于甲烷氧化的反应速率.(填“大于”、“小于”或“等于”)
| 化学方程式 | 焓变 △H/(kJ•mol-1) | 活化能 Ea/(kJ•mol-1) | |
| 甲烷氧化 | CH4(g)+2O2(g)═CO2(g)+2H2O(g) | -802.6 | 125.6 |
| CH4(g)+O2(g)═CO2(g)+2H2(g) | -322.0 | 172.5 | |
| 蒸汽重整 | CH4(g)+H2O(g)═CO(g)+3H2(g) | +206.2 | 240.1 |
| CH4(g)+2H2O(g)═CO2(g)+4H2(g) | +165.0 | 243.9 |
(1)反应CO(g)+H2O(g)═CO2(g)+H2(g)的△H=-41.2kJ•mol-1.
(2)在初始阶段,甲烷蒸汽重整的反应速率小于甲烷氧化的反应速率.(填“大于”、“小于”或“等于”)
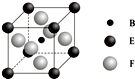 A、B、C、D、E、F、G七种前四周期元素且原子序数依次增大,A的最高正价和最低负价的绝对值相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子s能级的电子总数与p能级的电子数相等,F的基态原子的3d轨道电子数是4s电子数的4倍,G2+的3d轨道有9个电子,请回答下列问题:
A、B、C、D、E、F、G七种前四周期元素且原子序数依次增大,A的最高正价和最低负价的绝对值相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子s能级的电子总数与p能级的电子数相等,F的基态原子的3d轨道电子数是4s电子数的4倍,G2+的3d轨道有9个电子,请回答下列问题: