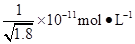题目内容
已知难溶性物质K2SO4·MgSO4·2CaSO4在水中存在如下平衡:
K2SO4·MgSO4·2CaSO4(s)=2Ca2++2K++Mg2++4SO42-,不同温度下,K+的浸出浓度与溶浸时间的关系如右图所示,则下列说法错误的是
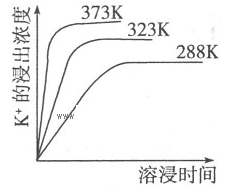
K2SO4·MgSO4·2CaSO4(s)=2Ca2++2K++Mg2++4SO42-,不同温度下,K+的浸出浓度与溶浸时间的关系如右图所示,则下列说法错误的是

| A.向该体系中加入饱和NaOH溶液,溶解平衡向右移动 |
| B.向该体系中加入饱和碳酸钠溶液,溶解平衡向右移动 |
| C.该平衡的Ksp=c(Ca2+)·c(K+)·c(Mg2+)·c(SO42-) |
| D.升高温度,反应速率增大,平衡向正反应方向移动 |
C
试题分析:向该体系中加入饱和氢氧化钠溶液时,氢氧根离子与镁离子反应生成难溶的氢氧化镁沉淀,降低了镁离子的浓度,使平衡向右移动,当加入碳酸钠溶液时,碳酸根离子与钙离子结合成碳酸钙沉淀,降低钙离子的浓度,使平衡向右移动,故A、B均正确;根据图像得出,温度越高,钾离子的浓度越大,说明升高温度,平衡向右移动,故D项正确;C项中平衡常数的表达式错误,故选C。

练习册系列答案
相关题目
 Mg2+(aq) + 2OH-(aq)
Mg2+(aq) + 2OH-(aq)
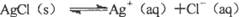 ”的理解正确的是( )。
”的理解正确的是( )。