题目内容
【题目】(1)甲烷制氢是一种廉价的制氢方法。有关的热化学方程式如下:
![]() ;
;![]() ①
①
![]() ;
;![]() ②
②
①下列说法正确的是 ______。
A.![]()
B.当反应①中![]() 时,表明该反应达平衡状态
时,表明该反应达平衡状态
C.其它条件不变时,增大体系压强,反应①②中甲烷的转化率均增大
D.为维持恒定温度![]() 不考虑热量损失
不考虑热量损失![]() ,某反应器中同时发生反应①与②时,消耗甲烷的物质的量之比为6:1
,某反应器中同时发生反应①与②时,消耗甲烷的物质的量之比为6:1
②某温度下,在100L反应器中充入甲烷和水蒸汽的物质的量分别为100mol和300mol时,假定只发生反应![]() 当甲烷的转化率为
当甲烷的转化率为![]() 时,此时平衡常数为 ______。
时,此时平衡常数为 ______。
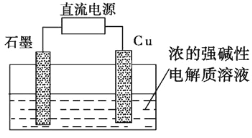
(2)蓝液是由![]() 、
、![]() 及NaOH配成的,在加热条件下,通过三步反应使铁表面生成一层致密的
及NaOH配成的,在加热条件下,通过三步反应使铁表面生成一层致密的![]() :
:
![]()
![]()
![]() ①
①
![]()
![]()
![]() ②
②
以及第三步生成四氧化三铁,请补充第三步反应的方程式并配平: ______。
①为了使铝表面形成较厚的氧化膜,工业上常用电解硫酸溶液的方法,在阳极上生成氧化铝,写出此时阳极的电极反应: ______。
②将固体草酸锰![]() 放在一个可以称出质量的容器里加热,固体质量随温度的变化关系如图所示
放在一个可以称出质量的容器里加热,固体质量随温度的变化关系如图所示![]() 质量单位为
质量单位为![]() :则
:则![]() 时,剩余固体的成分为 ______(填化学式);在
时,剩余固体的成分为 ______(填化学式);在![]() ,剩余固体的成分为 ______(填化学式)。
,剩余固体的成分为 ______(填化学式)。
【答案】D ![]()
![]()
![]()
![]() MnO
MnO
【解析】
(1)①已知:
![]() ;
;![]() ①
①
![]() ;
;![]() ②
②
A.由反应②-①可计算H2O(g)=H2(g)+![]() O2(g)的△H=+252kJmol-1,则2H2O(g)=2H2(g)+O2(g)△H=+504kJmol-1,气态水的能量比液态水能量高,故A错误;
O2(g)的△H=+252kJmol-1,则2H2O(g)=2H2(g)+O2(g)△H=+504kJmol-1,气态水的能量比液态水能量高,故A错误;
B.当反应①中υ(CH4)正=υ(CO)正时,依据速率之比等于化学方程式计量数之比,均是正反应速率之比,不能表明该反应达平衡状态,故B错误;
C.反应均为气体体积增大的反应,增大压强,平衡逆向移动,所以反应①②中甲烷的转化率均减小,故C错误;
D.维持恒定温度,吸收与放出的热量相等,则反应器中同时发生反应①与②时,消耗甲烷的物质的量之比为![]() =6:1,故D正确;
=6:1,故D正确;
故答案为D;
②结合题意,列“三段式”:
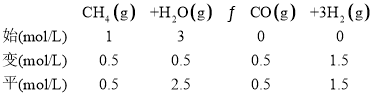
K=![]() =1.35;
=1.35;
(2)由①②及生成四氧化三铁可知,Na2FeO2、Na2Fe2O4发生反应,该反应为Na2FeO2+Na2Fe2O4+2H2O=Fe3O4↓+4NaOH;
①在阳极上生成Al失去电子生成氧化铝,阳极电极反应为3H2O+2Al-6e-=Al2O3+6H+;
②设生成MnC2O4的质量为x,
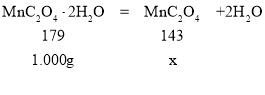
![]() ,解得x≈0.8g,则214℃时,结合图表,结晶水已全部失去,剩余固体的成分为MnC2O4;280℃时,由固体质量在减小,则草酸锰分解生成的锰的氧化物,可能是MnO或MnO2,根据锰元素守恒,
,解得x≈0.8g,则214℃时,结合图表,结晶水已全部失去,剩余固体的成分为MnC2O4;280℃时,由固体质量在减小,则草酸锰分解生成的锰的氧化物,可能是MnO或MnO2,根据锰元素守恒,
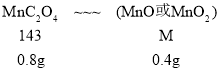
![]() ,解得M=71,则280℃时分解完全,剩余固体的成分为MnO。
,解得M=71,则280℃时分解完全,剩余固体的成分为MnO。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案