题目内容
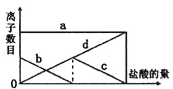
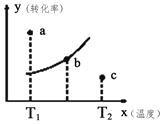
【题目】黄铁矿(主要成分FeS2)是工业制硫酸的主要原料,暴露在空气中会被缓慢氧化,其氧化过程如图所示。

(1)写出a步骤离子方程式________
(2)如何检验b步骤反应后的溶液中含Fe2+________
(3)取10mLb步骤反应后的溶液测定其成分,通入标准状况下Cl222.4mL恰好完全反应。然后调节pH,使溶液中的铁元素全部转化为沉淀,经过滤、洗涤、灼烧,冷却后称重,得固体质量为0.32g,则该溶液中c(Fe3+)=________(写出计算推理过程)
【答案】2FeS2+7O2+2H2O= 4SO42- +2Fe2+ +4H+ 取少量溶液于试管中,滴加酸性高锰酸钾溶液,若溶液褪色,则溶液中含有Fe2+ 0.2molL-1
【解析】
(1)步骤a中反应物为FeS2和O2,生成物为SO42-、Fe2+,结合得失电子守恒、电荷守恒和原子守恒可得该反应的离子方程式为:![]() ;
;
(2)Fe2+具有氧化性,能使酸性KMnO4溶液褪色,因此可用酸性KMnO4溶液检验Fe2+,其实验过程为:取少量溶液于试管中,滴加酸性KMnO4溶液,若溶液褪色,则溶液中含有Fe2+,故答案为:取少量溶液于试管中,滴加酸性高锰酸钾溶液,若溶液褪色,则溶液中含有Fe2+。
(3)得到的0.32g固体为Fe2O3,其物质的量![]() , 根据铁元素守恒可得,通入氯气后的溶液中n(Fe3+)=0.002mol×2=0.004mol;通入Cl2的物质的量
, 根据铁元素守恒可得,通入氯气后的溶液中n(Fe3+)=0.002mol×2=0.004mol;通入Cl2的物质的量![]() ,其发生反应的离子方程式为
,其发生反应的离子方程式为![]() ,因此通入氯气前的溶液中n(Fe2+)=0.002mol,因此通入氯气前的溶液中n(Fe3+)=0.004mol-0.002mol=0.002mol,所以该溶液中
,因此通入氯气前的溶液中n(Fe2+)=0.002mol,因此通入氯气前的溶液中n(Fe3+)=0.004mol-0.002mol=0.002mol,所以该溶液中![]() 。故答案为:0.2molL-1
。故答案为:0.2molL-1

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案
相关题目