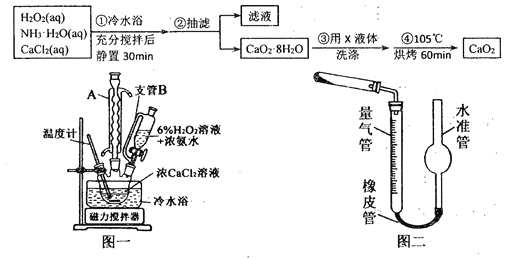
题目内容
【题目】常温时,若Ca(OH)2和CaWO4(钨酸钙)的沉淀溶解平衡曲线如图所示(已知![]() =0.58)。下列分析不正确的是
=0.58)。下列分析不正确的是
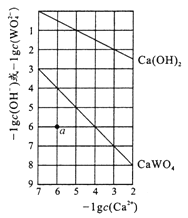
A. a点表示Ca(OH)2与CaWO4均未达到溶解平衡状态
B. 饱和Ca(OH)2溶液和饱和CaWO4溶液等体积混合: c(OH-)>c(H+)>c(Ca2+)>c(WO42-)
C. 饱和Ca(OH)2溶液中加入少量Na2O,溶液变浑浊
D. 石灰乳与0.1mol/LNa2WO4溶液混合后发生反应:Ca(OH)2+WO42-=CaWO4+2OH-
【答案】B
【解析】A项,如图,为Ca(OH)2和CaWO4(钨酸钙)的沉淀溶解平衡曲线,曲线上的点都代表平衡状态,则Ksp[Ca(OH)2]=c(Ca2+)c2(OH-)=10-7,Ksp(CaWO4)=c(Ca2+)c(WO42-)=10-10,a点的浓度商Q[Ca(OH)2]=c(Ca2+)c2(OH-)=10-18小于Ksp[Ca(OH)2],Q(CaWO4)=c(Ca2+)c(WO42-)=10-12小于与Ksp(CaWO4),所以a点表示Ca(OH)2与CaWO4均未达到溶解平衡状态,故A正确。B项,设饱和Ca(OH)2溶液中,c(Ca2+)=x,则c(OH-)=2x,根据Ksp[Ca(OH)2]=c(Ca2+)c2(OH-)=10-7,则x(2x)2=10-7,解得x=![]() ;设饱和CaWO4溶液中,c(Ca2+)=y,则c(WO42-)=y,根据Ksp(CaWO4)=c(Ca2+)c(WO42-)=10-10,则y2=10-10,解得y=10-5;混合时:c(Ca2+)=
;设饱和CaWO4溶液中,c(Ca2+)=y,则c(WO42-)=y,根据Ksp(CaWO4)=c(Ca2+)c(WO42-)=10-10,则y2=10-10,解得y=10-5;混合时:c(Ca2+)=![]() (
(![]() )≈
)≈![]()
![]() =
=![]() =
=![]() ,c(OH-)=
,c(OH-)=![]() ,c(H+)=
,c(H+)=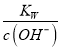 =0.29×10-12,c(WO42-)=
=0.29×10-12,c(WO42-)=![]() ×10-5,Q(CaWO4)=c(Ca2+)c(WO42-)=
×10-5,Q(CaWO4)=c(Ca2+)c(WO42-)=![]() ×
×![]() ×10-5大于Ksp(CaWO4),所以混合后会析出CaWO4,但是溶液中减小的c(Ca2+)=c(WO42-)肯定会小于
×10-5大于Ksp(CaWO4),所以混合后会析出CaWO4,但是溶液中减小的c(Ca2+)=c(WO42-)肯定会小于![]() ×10-5,所以沉淀后溶液中c(Ca2+)还是10-2级别,根据Ksp(CaWO4)=10-10可推出c(WO42-)是10-8级别,而前面已求得c(H+)=0.29×10-12。综上分析,c(OH-)>c(Ca2+)>c(WO42-)>c(H+),故B错误。C项,Na2O和水反应使水减少,饱和Ca(OH)2溶液中,Q[Ca(OH)2]>Ksp[Ca(OH)2],析出Ca(OH)2固体,所以溶液变浑浊,故C正确。D项,由前面的分析可知CaWO4比Ca(OH)2更难溶,所以石灰乳与0.1mol/LNa2WO4溶液混合后,会发生反应Ca(OH)2
×10-5,所以沉淀后溶液中c(Ca2+)还是10-2级别,根据Ksp(CaWO4)=10-10可推出c(WO42-)是10-8级别,而前面已求得c(H+)=0.29×10-12。综上分析,c(OH-)>c(Ca2+)>c(WO42-)>c(H+),故B错误。C项,Na2O和水反应使水减少,饱和Ca(OH)2溶液中,Q[Ca(OH)2]>Ksp[Ca(OH)2],析出Ca(OH)2固体,所以溶液变浑浊,故C正确。D项,由前面的分析可知CaWO4比Ca(OH)2更难溶,所以石灰乳与0.1mol/LNa2WO4溶液混合后,会发生反应Ca(OH)2

 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案【题目】某小组在验证反应“2Fe3+ + Cu =2Fe2+ + Cu2+”的实验中观察到溶液颜色由棕黄色变为浅绿色,且产生灰白色沉淀。发现和探究过程如下。
实验过程 | 实验现象 | |
实验1 |
| 充分振荡,棕黄色溶液逐渐变浅,最后呈浅绿色,有灰白色固体产生 |
实验1中所得溶液的颜色比预期的浅,针对其原因进行探究。
(1)甲认为:实验后,溶液中c (Cu2+)应为0.5 mol/L。“溶液颜色浅”是c (Cu2+)低于0.5 mol/L造成的。 配制含0.5 mol/L CuCl2和____________mol/L FeCl2混合溶液,观察溶液的颜色。该溶液为蓝绿色,明显比实验所得溶液颜色深,说明_________________________。
(2)甲进一步研究认为,“溶液颜色浅”与产生了灰白色固体有关。
甲查阅资料如下,猜想灰白色固体可能含有CuCl。
资料:CuCl是白色固体,不溶于水、硫酸,可溶于氨水。
为探究灰白色固体成分,设计实验方案如下:
方案1 | 用蒸馏水将实验1中的灰白色固体混合物洗净,取少量,加入过量稀硝酸,如果有白色固体剩余,则证明有CuCl |
方案2 | 用蒸馏水将实验1中的灰白色固体混合物洗净,取少量,加入浓氨水浸泡,过滤,向滤液中加入稀硫酸 |
a.按方案1进行实验2:
b.加入稀硝酸的目的是___________,反应的离子方程式是____________________________________。
c.乙认为该方案不严谨,理由是:CuCl具有还原性,被硝酸氧化后的生成物能溶于稀硝酸。
d.按方案2进行实验3:
e.加入稀硫酸时,产生的实验现象是____________,说明灰白色固体中含有CuCl。
(3)综合上述实验,说明实验1所得溶液的颜色比预期浅的原因是_____________________________。